
作者 l Alpharesearch
编辑 l 细胞房间
全球首个双特异性抗体Removab(catumaxomab,卡妥索抗体),于2009年获得EMA批准在欧洲上市,成为全球第一个上市的双特异性抗体,由于商业、适应症选择、疗效、副反应等等原因最终停产退市。其发明人Horst Lindhofer博士则认为该双抗仍然具有相当大的商业价值,重建新的公司积极推动其再上市。在中国,Lindhofer博士作为凌腾医药(Lintonpharm)的联合创始人,已提交卡妥索抗体的临床试验申请,目前已获得受理。
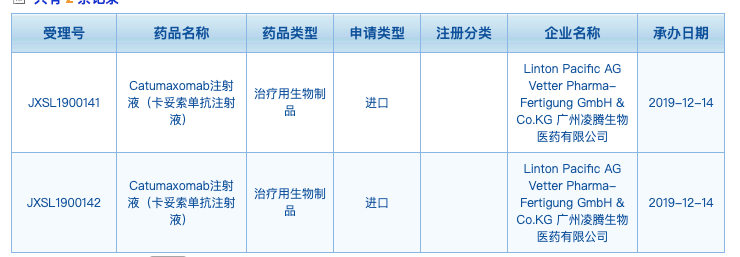
从公司官网的介绍来看,Lindhofer博士正雄心勃勃的开启卡妥索抗体重返市场之路。在中国的临床申请可能为,恶性腹水、非肌层浸润性膀胱癌以及局部复发性结肠癌。
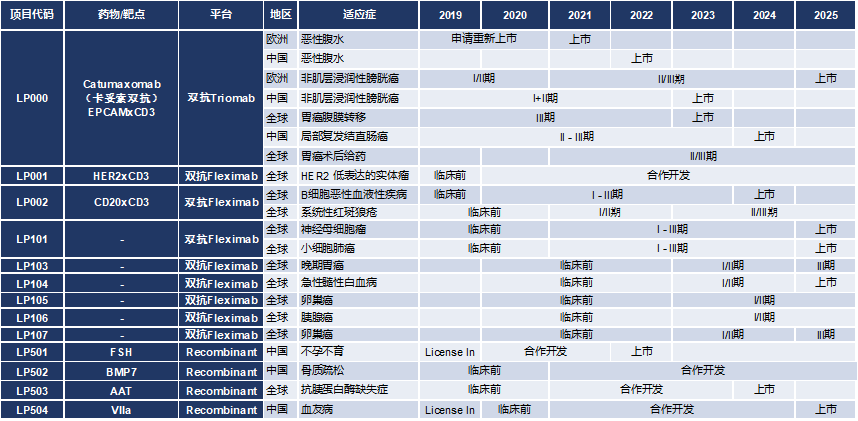
时过境迁,卡妥索抗体还有多少机会,小编对该品种的态度表示消极。
首先来简单了解下catumaxomab。Catumaxomab是一种mouse的IgG2a与rat的IgG2b杂合而成的双特异性抗体,通过大鼠/小鼠杂交瘤(quadroma)细胞系表达产生。
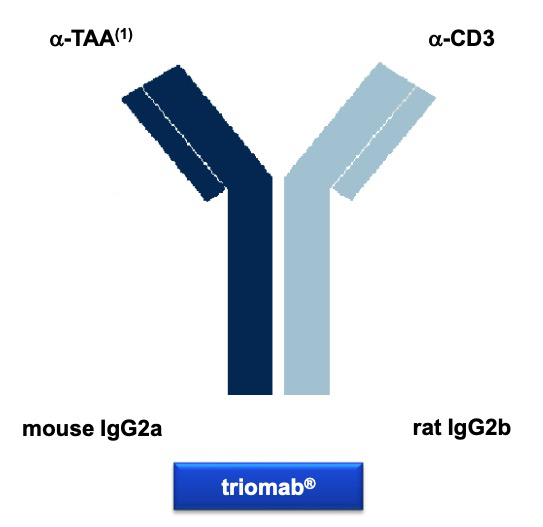
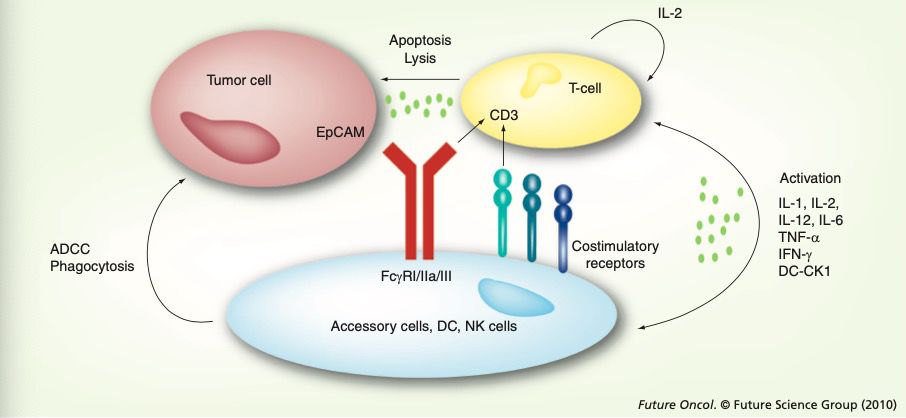
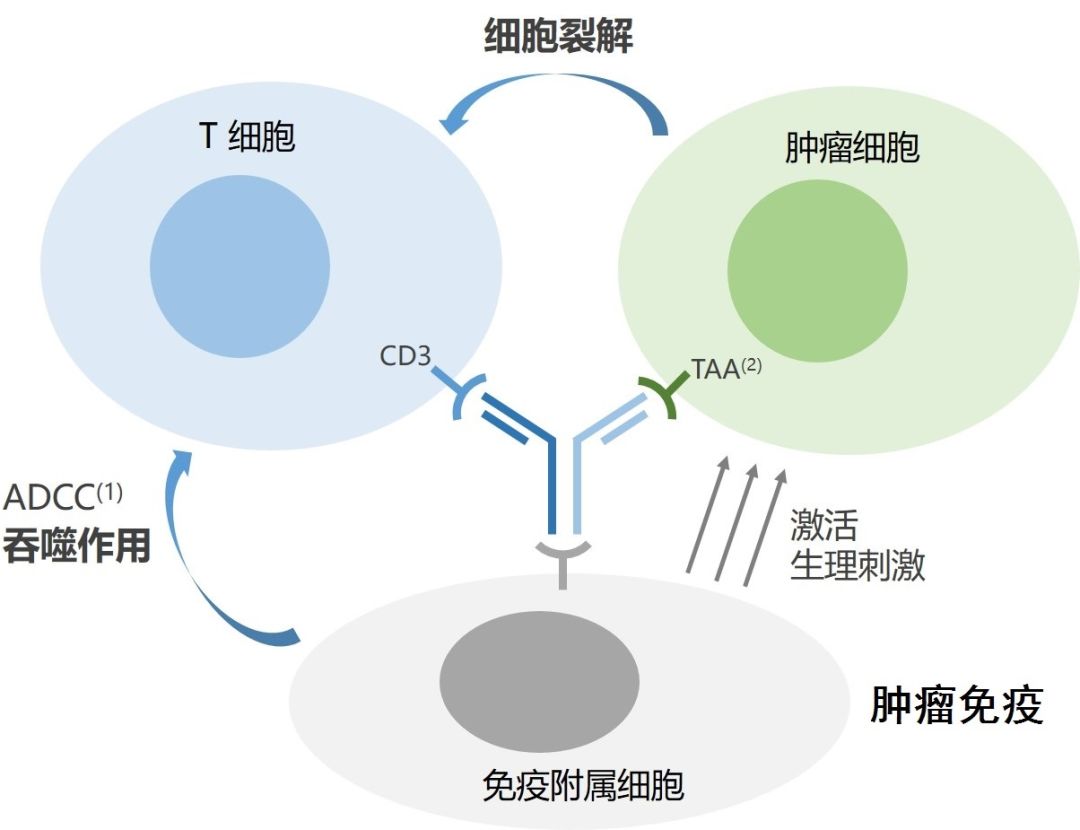
从功能上讲catumaxomab同时靶向腹腔肿瘤广泛表达的EpCAM表皮粘附因子以及CD3的双特异性三功能抗体。一方面结合肿瘤表面标记(EpCAM),一方面牵引T细胞(CD3),发挥细胞杀伤作用,也就是现在双抗领域最为常用的 T-cell Engager(T细胞衔接)技术。此外,catumaxomab保留了激动型FcrR受体结合功能而对抑制型受体保持低亲和力,故能够与DC细胞、巨噬细胞以及NK细胞结合,发挥ADCC、ADCP功能以及通过共刺激因子促进T细胞释放多种细胞因子。
尽管现在看来,这种基于肿瘤免疫治疗的分子设计是稀松平常,但是在20多年通过肿瘤免疫治疗并未受到广泛的认可和证实,这种设计是具有极强的创新精神的。然而科学的巨轮滚滚向前,最近十几年二十年,双抗技术平台以及肿瘤免疫治疗的发展,以远非当日能比。我并不看好catumaxomab此次回归之路。
硬伤很明显:
如上文所言catumaxomab是一个全鼠源的双抗(小鼠IgG2a/大鼠IgG2b),非常容易产生HAMA(人抗鼠抗体)。从此前的数据中也可以看出,在第0, 3, 7 和10 天分别进行10, 20, 50 和 150ug四次注射后,70%的患者出现了HAMA。抗体的发展从鼠源到嵌合到人源化再到全人源,目前鼠源抗体几乎已经绝迹,catumaxomab在这方面可谓先天不足。
机制有怀疑:
如前文所言,catumaxomab不但具有通过T细胞衔接发挥肿瘤杀伤功能,还具有与激动型FcrR受体结合功能,发挥ADCC/ADCP等能力。
然而目前绝大多数保留有Fc区域的双抗候选产品在设计的过程中,都选择通过突变和Fc亚型的选择弱化FcrR受体结合能力。思路不难理解,如果保留有FcrR结合和激活能力,怎么能保证所NK/巨噬细胞所介导的ADCC/ADCP功能都去杀伤肿瘤细胞,毕竟Fab的另一端连接在T细胞上,T细胞没有被消灭的风险?
CD3抗体需优化:
双抗的快速发展,不但在于结构技术平台的不断丰富,靶点之间的亲和力优化和平衡也得到了充分的认识。
对于靶向CD3的 T-cell Engager平台而言,CD3抗体的亲和力对平衡安全性和有效性有着至关重要的作用。目前认为CD3的亲和力在30-100nM比较理想,比较好的平衡了T细胞的活性和细胞因子风暴的风险。CD3亲和力大于200nM,可能会面临无T细胞杀伤活性,而小于10nM则面临着较高的细胞因子风暴风险。Catumaxomab的CD3亲和力为4.4nM,具有较高的CRS风险,此前在临床上也表现出了细胞因子风暴风险。

竞争很激烈:
目前超过100种在研的双特异性抗体,一半以上是基于同时靶向肿瘤抗原以及CD3的 T-cell Engager。
对于EpCAM/CD3靶点而言,全球范围内安进的Solitomab(基于BiTE平台)已经进入临床,亿帆医药(原健能隆)的A-337已在澳洲开展临床。而武汉友芝友的M701也在中国进入了临床阶段,对比catumaxomab其在人源化改造和CD3亲和力优化方面具有较大的优势。
无论如何,catumaxomab作为第一款上市的双抗是具有划时代意义的,在当时而言也具有先进的科学思维和设计理念,同样也是受困于时代它本身也有许多硬伤。
最后忍不住吐槽下,凌腾医药的官网做的真是太不走心了,做为公司最重要的宣传媒介,连机制作用图都画错了。肿瘤细胞和T细胞的位置明显标记错了,这难道是要让肿瘤细胞和免疫细胞杀伤T细胞,发挥免疫抑制作用!
[1] 凌腾医药官网;
[2] CDE官网;
[3] Chelius D, et al. Structural and functional characterization of the trifunctional antibody catumaxomab[J]. MAbs. 2010, (3):309-19.
[4] Ruf P and Lindhofer H. Induction of a long-lasting antitumor immunity by a trifunctional bispecific antibody[J]. Blood. 2001, 98(8):2526-34.
[5] Zeidler R, et al. The Fc-region of a new class of intact bispecific antibody mediates activation of accessory cells and NK cells and induces direct phagocytosis of tumour cells[J]. Br J Cancer. 2000, 83(2):261-6.

投稿/转载请联系微信:wzh910605
商务合作联系:18868193180
欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。
21位小编成员:Armstrong、医药局外人、Fairy、Jone、东胜西牛、Alpharesearcher、MT、百草、Irene、Self Renew、蛋白工人、At.Zhou、Julia、游方和尚、Grand、夕阳武士、吃瓜群众、Nathan、神经元、Clear兮、南山南
















