
6月22日,国家食品药品监督管理总局局长毕井泉受国务院委托,向全国人大常委会报告药品管理工作时表示,我国已经基本消除了药品注册申请积压,等待审评的注册申请已从2015年高峰时的22000件降至6000件。化学药和疫苗临床试验申请、中药各类注册申请已实现按时限审评。
适值2017年年中刚过,各种半年报告相继出炉,本文即以药智数据库为基础,评价了2017年上半年CDE对各种化学药品临床、生产申报的审评速度,重点评价了各类化药申报审评速度最快的品种。
一、化药临床与生产申报整体审评概况
2017年上半年,各类化药临床与生产注册申报整体审评概况如表1所示。
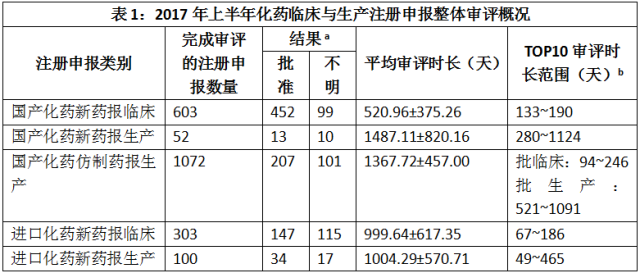
点击图片放大查看更清晰
注:
a 对应注册申报的数量
b 合并关联申报后的统计结果
二、国产化药新药报临床(CXHL)
2017年上半年,CDE共完成603个国产化药新药报临床注册申报的审评工作,平均审评时长为520.96±375.26天。其中,已知批准临床的批件452个。2017年上半年完成审评的各类国产化药新药报临床注册申报的审评时长如表2所示。
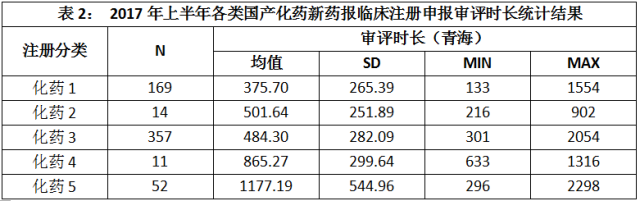
点击图片放大查看更清晰
1、整体TOP10名单
合并关联申报后,审评速度最快的10个注册申报如表3所示。
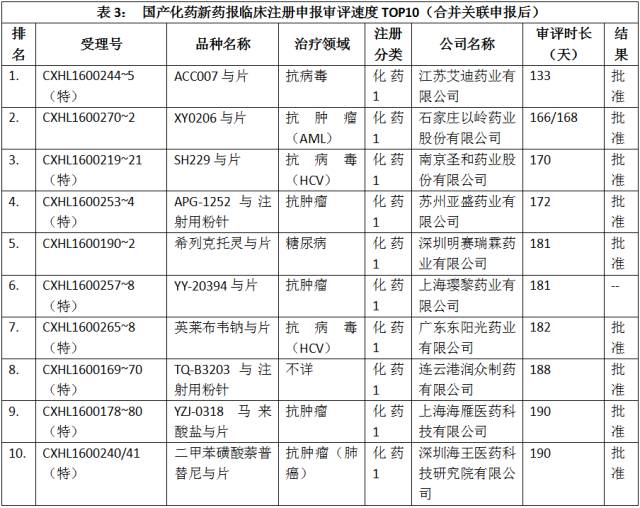
点击图片放大查看更清晰
不出所料的是,审评速度最快是10种报临床的国产化药新药注册申报均为1类新药。另统计发现,2017年上半年,CDE共完成169个1类新药报临床注册申报的审评工作,平均审评时长375.70±265.39天。其中,已知批准临床的注册申报139个,共涉及54个新分子实体。审评速度最快的前23个国产化药新药报临床注册申报(合并关联申报后)均为1类新药。
2、3类新药审评速度TOP10
合并关联申报后,审评速度最快的10个3类新药报临床注册申报如表4所示。
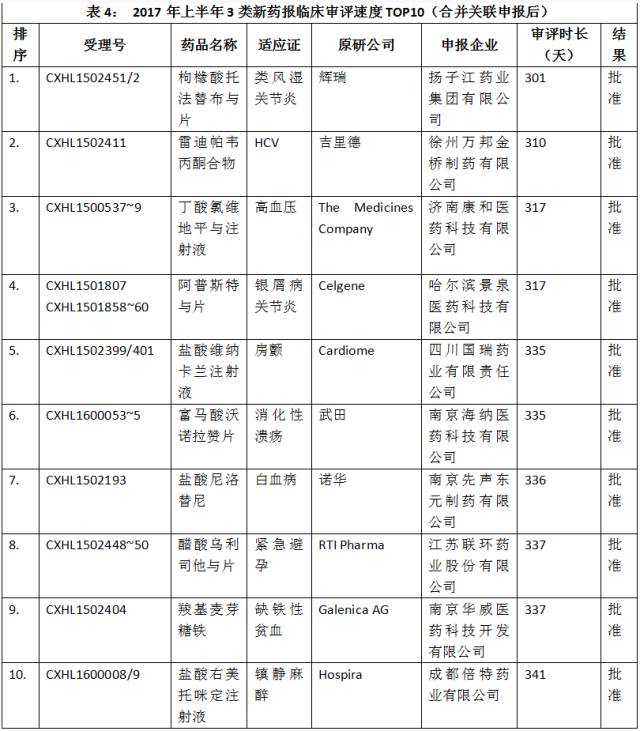
点击图片放大查看更清晰
三、国产化药新药报生产(CXHS)
2017年上半年,CDE共完成52个国产化药新药报生产注册申报的审评工作,平均审评时长为1487.11±820.16天。
1、批准临床的注册申报
2017年上半年,批准临床的国产化药新药报生产注册申报如表5所示。
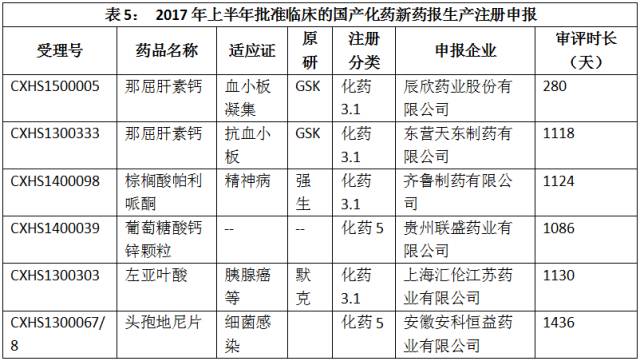
点击图片放大查看更清晰
2、批准生产的注册申报
2017年上半年批准生产的国产化药新药报生产注册申报如表6所示。
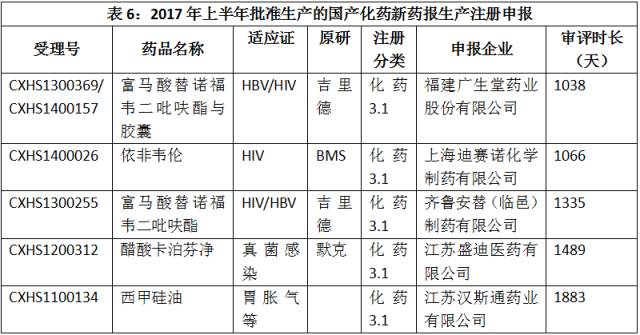
点击图片放大查看更清晰
四、国产化药仿制药报生产(CYHS)
2017年上半年,CDE共完成1072年国产化药仿制药报生产注册申报的审评工作,平均审评时长为1367.72±457.00天,其中,已知获准生产的批件69件,获准临床的批件138个。
1、批准临床审评速度TOP10
合并关联申报后,批准临床的注册申报的审评速度最快的10个注册申报如表7所示。
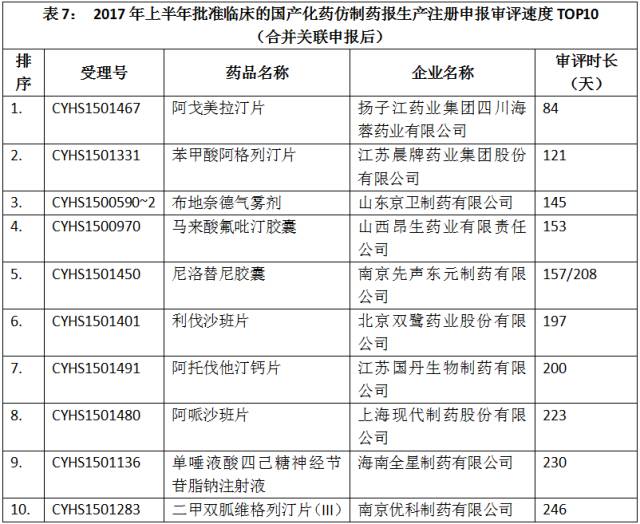
点击图片放大查看更清晰
2、批准生产审评速度TOP10
合并关联申报后,批准生产的注册申报的审评速度最快的10个注册申报如表8所示。
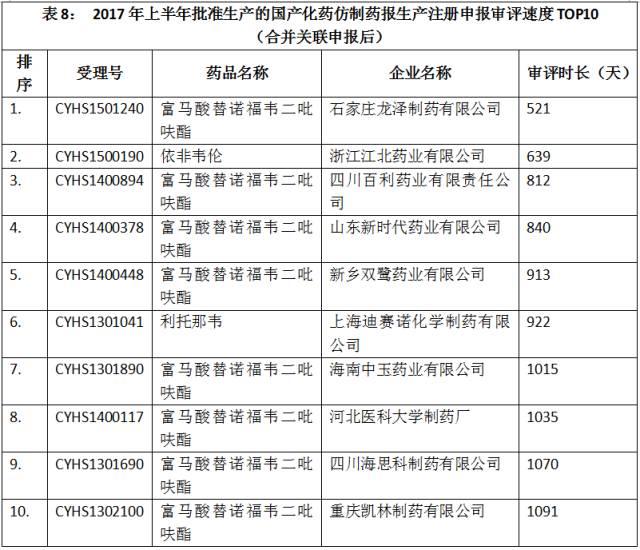
点击图片放大查看更清晰
五、进口化药新药报临床(JXHL)
2017年上半年,CDE共完成303个进口化药新药报临床注册申报的审评工作,平均审评时长为999.64±617.35天,其中,已知获准临床者147个。
合并关联申报后,审评速度最快的10个注册申报如表9所示。
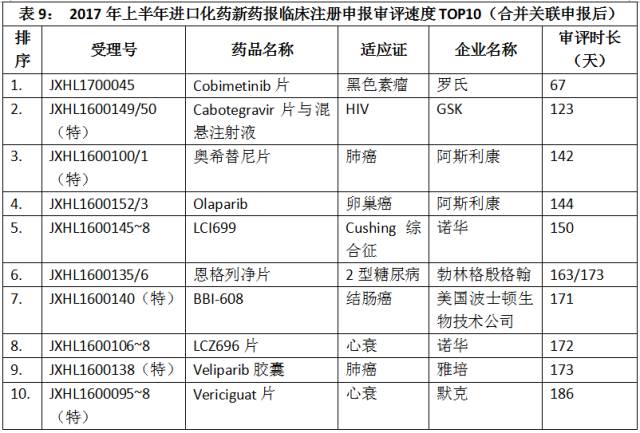
点击图片放大查看更清晰
六、进口化药新药报生产(JXHS)
2017年上半年,CDE共完成100个进口化药新药报生产注册申报的审评工作,平均审评时长1004.29±570.71天。合并关联申报后,所有已知获准进口的注册申报如表10所示(按审评时长排序)。
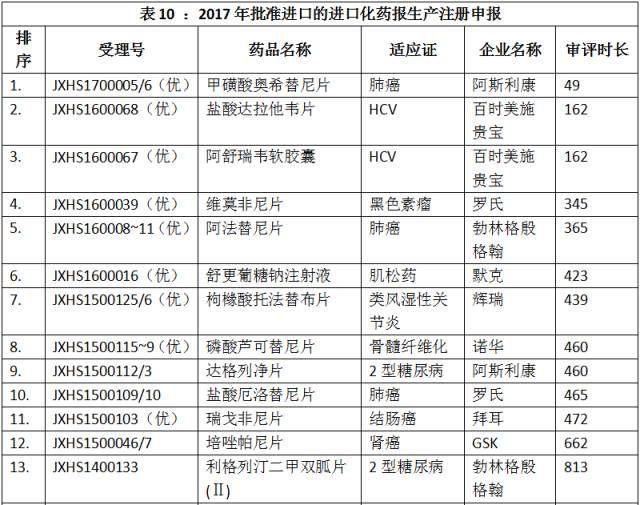
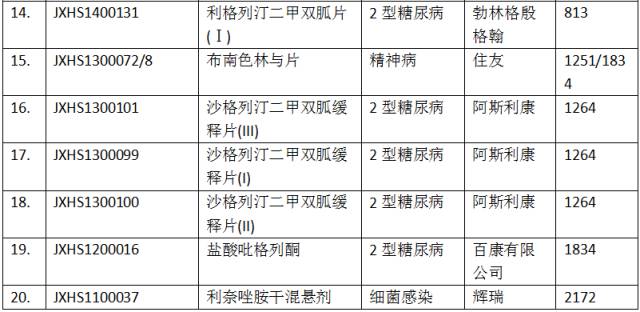
点击图片放大查看更清晰
七、结论与讨论
“药品审评速度慢、积压申请多”是由多种原因造成的历史问题,也曾经一度将CFDA与CDE推到舆论的风口浪尖,不但影响企业开发药品的重要性,也限制了公众获取廉价、等效的药品的途径,从而加重了社会医疗负担。为了解决这一问题,2015年7月31日,国家食品药品监督管理总局发布了“关于征求加快解决药品注册申请积压问题的若干政策意见的公告”,2016年2月28日又发布了《关于解决药品注册申请积压实行优先审评审批的意见》,从而大大加快了各类药品注册申报审评速度,解决了大量的积压申请。而2017年6月,CFDA又发布了两部关于eCTD(药品电子技术通用技术文档)的征求意见稿,意味着中国药品审查距离eCTD时代越来越近,再加上中国加入ICH后带来的积极影响,可以预见,未来药品审查会更便捷、高效、规范、环保。
本文转载自药智网
点击阅读原文,查看更多精彩资讯与行业报告
















