临床低血糖是指血浆(或血清)葡萄糖浓度低至足以产生包括大脑功能受损在内的症状及(或)体征。低血糖的临床表现没有特异性,可从行为改变、乏力、精神错乱到癫痫和意识丧失,即功能性大脑衰竭。血糖水平上升后上述症状通常可完全缓解。其影像学提示低血糖脑病常常累及大脑皮质、基底节区、海马、胼胝体和双侧内囊等区域,本文结合几个病例向大家介绍一下低血糖脑病的影像表现。
1.大脑皮层病变
严重低血糖的患者可出现类似于弥漫性缺血-缺氧患者的影像学表现,常常累及大脑皮层、皮质下白质以及海马,双侧多不完全对称,右侧更常见。影像学表现T2/FLAIR及DWI像高信号。
病例1.21岁青年男性,长期嗜酒,饮酒后昏迷诊断为低血糖脑病。
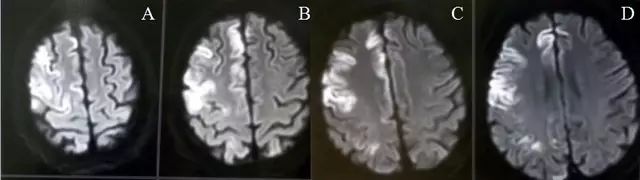
图1.DWI显示右侧额叶脑皮质及顶叶皮层下多发高信号(A-D)。
2.双侧基底节区对称性病变
基底节区与大脑皮层同属于大脑灰质,此处因含有大量神经元胞体对缺血、缺氧及能影响能量代谢的疾病十分敏感,因此基底节区在肾性脑病、肝性脑病、低血糖脑病等疾病中常常早期受累。
病例1.21岁青年男性,长期嗜酒,饮酒后昏迷诊断为低血糖脑病。
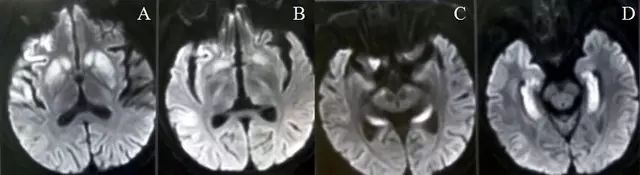
图2.DWI显示双侧尾状核、壳核(A-B)和海马(C-D)高信号。
病例2.患者女性,81岁,出现持续性低血糖、癫痫发作及感觉障碍。
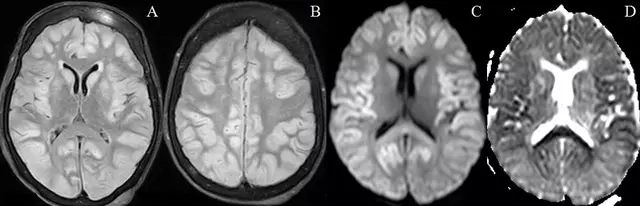
图3.患者低血糖事件发生后第7天FLAIR(A、B)提示两侧大脑半球和基底节皮层高信号。DWI和ADC(C、D)提示皮质和胼胝体压部扩散受限。
病例3.一位60岁女性糖尿病患者,注射过量胰岛素自杀未遂。
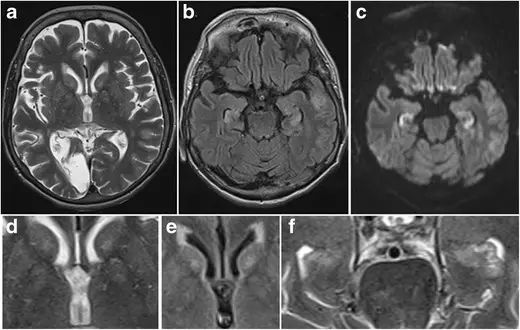
图4.患者入住ICU7天后MRI显示双侧尾状核和豆状核轻度T2高信号(a),其在轴位T2及FLAIR放大像上更加明显(d,e)。T2像及DWI像同样显示海马高信号(b,c).海马T2放大像更好的显示海马头高信号(f)。
3.内囊及皮质下白质
双侧内囊病变常常见于遗传性脑白质营养不良及肌萎缩侧索硬化,如X-连锁肾上腺脑白质营养不良、Krabbe病、脑腱黄瘤病等等,有文献报道同样可以见于低血糖脑病。
病例4.一例72岁女性患者因精神改变入院,确诊为低血糖脑病。
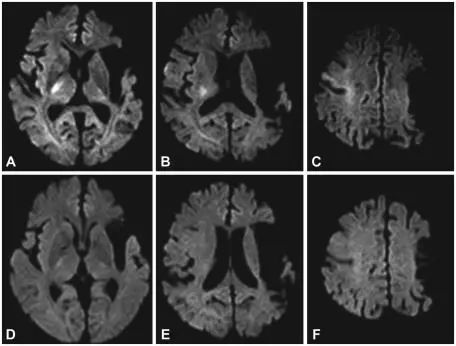
图5.初始影像(A-C)显示右侧内囊、侧脑室旁白质和额叶高信号。随访影像(D-F),显示最初的高信号消失。
病例5.75岁女性患者,入院前突发意识障碍,确诊为低血糖脑病。
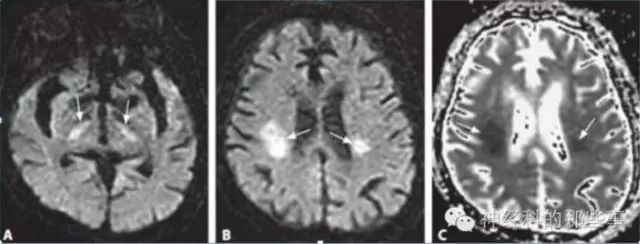
图6.DWI显示双侧内囊(A)及侧脑室周围(B)高信号,ADC呈低信号(C)。
4.可逆性胼胝体压部病变综合征
可逆性胼胝体压部病变综合征是近年来提出的一种由各种病因引起的累及胼胝体压部的临床影像综合征。其特点为MRI上可见胼胝体压部的卵圆形、非强化病灶,一段时间后可完全消失。可以引起RESLES的代谢异常包括由胰岛素治疗或口服降糖药引起的严重低血糖以及各种原因引起的高钠血症。
病例6.22 岁女性,表现为突发意识障碍,诊断为低血糖脑病。
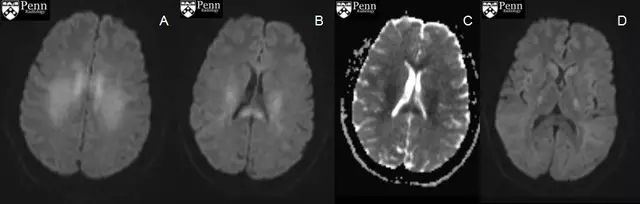
图7.头颅 MRI:脑白质(A)、胼胝体压部(B-C)和内囊弥散(D)受限,FLAIR(D)上尾状核头部信号异常。
病例7.患者女性,68岁,因反应迟钝送至医院诊治,确诊为低血糖脑病。
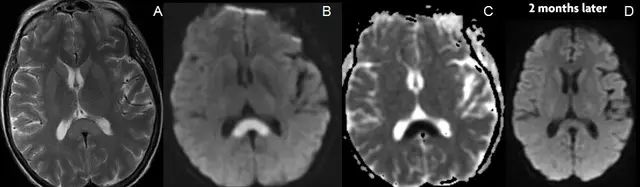
图8.头颅MRI横断面T2WI(图A)、DWI(图B)和ADC 像(图 C)显示胼胝体压部变大,T2像信号轻度增高,无增强。2个月后随访,MRI显示信号已恢复正常(图D)。
5.双侧小脑中脚受累
双侧桥臂病变其病因复杂,涉及脑血管病、神经系统变性疾病、脱髓鞘疾病等几乎所有CNS病。一些全身性疾病,包括内分泌及代谢性疾病、中毒、感染及其它疾病,也可导致继发性桥臂受损。
病例8.一名60岁女性表现为低血糖昏迷。
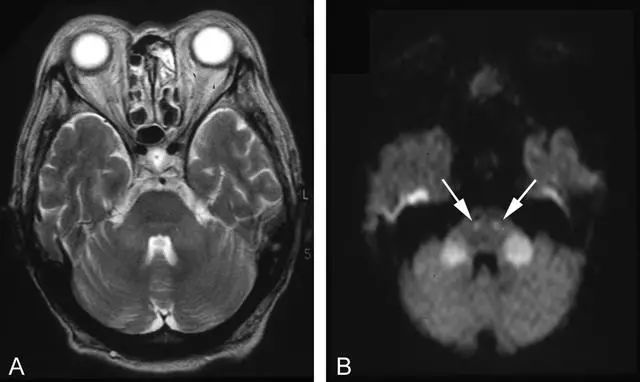
图9.入院时T2像显示轻度双侧小脑中脚高信号(A),DWI示双侧小脑中脚高信号(B)。另外,双侧锥体束可见对称性高信号(白箭头)。第二天复查MRI时这些变化均消失(未显示)。
综上所述,低血糖脑病常常累及大脑皮质及基底节区灰质以及内囊、胼胝体、小脑中脚等神经纤维密集的区域,影像学多无特征性,当如上区域出现病变时要想到低血糖脑病的可能,结合病史可确诊。
编辑 | 巩涛
责任编辑 | 李晴
投稿与合作:[email protected]
参考资料
1.Lee S-H, Kang CD, Kim SS, et al. Lateralization of Hypoglycemic Encephalopathy: Evidence of a Mechanism of Selective Vulnerability. Journal of Clinical Neurology (Seoul, Korea). 2010;6(2):104-108. doi:10.3988/jcn.2010.6.2.104.
2.Malik AM. The Reversible Corpus Callosum Splenium Lesion Associated With Hypoglycemic Encephalopathy. The Neurohospitalist. 2013;3(3):169. doi:10.1177/1941874413476044.
3.Dekeyzer S, De Kock I, Nikoubashman O, et al. “Unforgettable” – a pictorial essay on anatomy and pathology of the hippocampus. Insights into Imaging. 2017;8(2):199-212. doi:10.1007/s13244-016-0541-2.
4.http://www.neurologyclub.org/nd.jsp?id=413&_np=0_35&nSL=%5B0%2C1%2C2%2C5%2C6%2C7%5D&skeyword=%25E5%258F%25AF%25E9%2580%2586%25E6%2580%25A7%25E8%2583%25BC%25E8%2583%259D%25E4%25BD%2593
5.http://neuro.dxy.cn/article/499203?keywords
6.Kouichirou Okamoto et al. MR Features of Diseases Involving Bilateral Middle Cerebellar Peduncles.AJNR Am J Neuroradiol. 2003;24:1946-1954





