
肺动脉高压是一类由各种原因导致肺血管阻力和肺动脉压力异常升高的高致死率疾病,全球人口患病率高达1%【1,2】。肺血管重塑是肺动脉高压的主要病理特征,主要发生在肺小血管和微血管中,包括肺微血管缺失和肺小血管肌化【3】。但是,目前尚缺乏针对修复肺微血管损伤,逆转肺血管重塑的有效治疗手段。多项研究报道了干/祖细胞(stem/progenitor cells, SPC)分化为内皮细胞和平滑肌细胞参与体循环血管内膜修复和中膜重塑【4-6】,提示调控SPC的分化有望修复损伤的肺微血管并逆转肺血管重塑。肺组织中也存在c-Kit+ SPC【7】,然而,肺组织c-Kit+ SPC在肺血管重塑中的分化改变及其潜在作用尚不清楚。2025年2月4日,中国医学科学院基础医学研究所王辰/王婧教授团队在Developmental Cell上发表了题为“Differentiation of Lung Tissue-resident c-Kit+ Cells into Microvascular Endothelial Cells Alleviates Pulmonary Vascular Remodeling”的研究论文,揭示了肺组织固有c-Kit+ SPC向微血管内皮细胞的分化改变及其在肺血管重塑中的作用。作者首先利用Kit-CreER;Rosa26-tdTomato谱系示踪小鼠建立SU5416联合低氧(SU5416/Hypoxia, SuHx)诱导的肺动脉高压小鼠模型,对肺组织c-Kit+细胞在肺动脉高压中的分化改变进行示踪。结果表明,在SuHx小鼠肺组织中,c-Kit+细胞主要分化为微血管内皮细胞;少数c-Kit+细胞分化为大血管平滑肌细胞,不直接参与肺小血管肌化。前期有研究认为骨髓来源的外周血循环内皮祖细胞(endothelial progenitor cell, EPC)具有向肺组织迁移并定植分化为肺血管内皮细胞的能力【8】。然而,这一观点目前具有争议。c-Kit也是循环EPC的标志物之一。因此,作者通过骨髓移植实验探究发生微血管内皮分化改变的c-Kit+细胞的来源。骨髓移植实验的结果表明,在SuHx诱导的肺动脉高压小鼠模型中,组织固有c-Kit+细胞在SuHx模型中发生了向肺微血管内皮细胞的分化,而骨髓来源的c-Kit+细胞则向CD45+免疫细胞分化。随后,作者利用白喉毒素诱导的c-Kit+细胞特异性敲除小鼠,结合骨髓移植,特异性敲除组织固有c-Kit+细胞后建立SuHx模型。结果显示,敲除组织固有c-Kit+细胞会加重SuHx诱导的小鼠肺血管重塑,表明组织固有c-Kit+细胞在肺动脉高压中具有保护作用。成熟的肺微血管内皮细胞具有很强的异质性,包括Connexin40+肺动脉内皮细胞(pulmonary arterial endothelial cell, PAEC),EphB4+肺静脉内皮细胞(pulmonary venous endothelial cell, PVEC)和参与气体交换的Ednrb+肺泡毛细血管内皮细胞(aerocyte)。接下来作者通过分选Kit-CreER;Rosa26-tdTomato小鼠肺组织tdTomato+细胞进行单细胞测序,进一步明确肺组织固有c-Kit+细胞的分化方向并分析其分化调控机制。RNA velocity、免疫荧光共定位和流式分析的结果显示,肺组织固有c-Kit+细胞具有向Connexin40+、Ephb4+和Ednrb+内皮细胞分化的潜能,但是在肺动脉高压中,肺组织固有c-Kit+细胞向Ephb4+和Ednrb+内皮细胞分化增加,而向Connexin40+内皮细胞的分化则无明显改变。作者对肺组织固有c-Kit+细胞进行进一步分群,得到了三个亚群,分别表达动脉发育相关的调控分子Notch1 (Notch1+)、静脉内皮细胞特化的关键调控转录因子Nr2f2 (Nr2f2+)和肺泡毛细血管发育的调控分子FoxF1 (FoxF1+)。其中,Nr2f2+亚群在SuHx小鼠肺组织中显著增加,可能与肺组织固有c-Kit+细胞向Ephb4+内皮细胞的分化有关。作者利用AAV作为载体,在小鼠体内靶向调控c-Kit+细胞Nr2f2的表达,探究Nr2f2对c-Kit+细胞分化和肺血管重塑的影响。研究发现,靶向上调c-Kit+细胞Nr2f2的表达可以促进其向Ephb4+内皮细胞的分化并减轻肺血管重塑,从而缓解肺动脉高压;而在体内抑制c-Kit+细胞Nr2f2的表达则会抑制其分化并加重肺动脉高压。综上所述,本研究揭示了肺组织固有c-Kit+细胞在肺血管重塑中的分化改变及其保护作用。研究发现,骨髓来源的循环EPC不向肺血管内皮细胞分化,而肺组织固有c-Kit+细胞则具有向不同类型的成熟内皮细胞分化的潜能,通过NR2F2调控肺组织固有c-Kit+细胞分化可以缓解肺血管重塑。靶向调控肺组织固有c-Kit+细胞的分化可以成为缓解肺动脉高压血管重塑的新策略。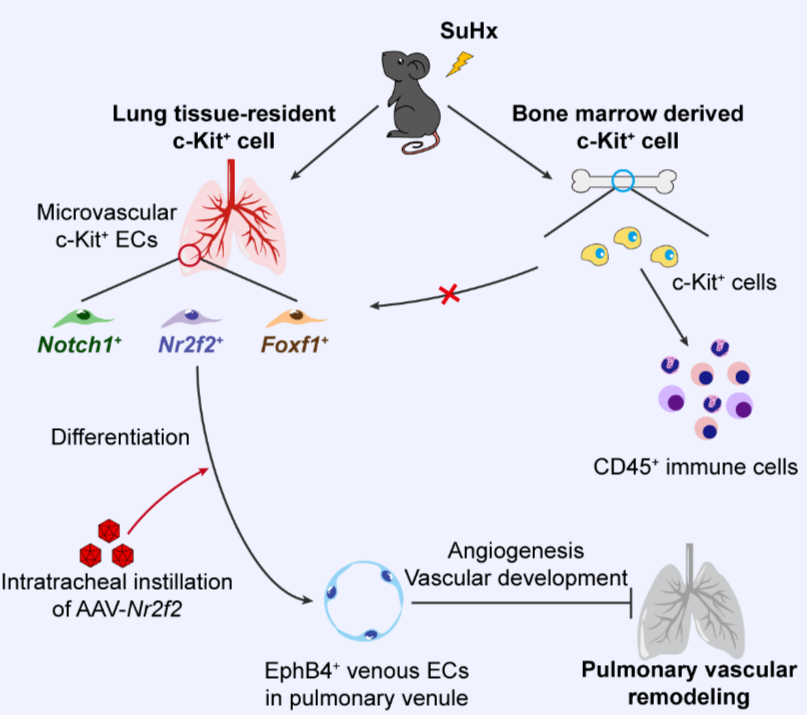
北京协和医学院基础学院李晋秋博士和“4+4”医学试点班周逸天博士为本研究的共同第一作者。中国医学科学院基础医学研究所呼吸和共病全国重点实验室王婧教授和邢岩江副研究员为本研究的共同通讯作者。该研究得到了中国科学院分子细胞科学卓越创新中心周斌研究员、华中科技大学同济医学院胡清华教授和四川大学华西第二医院生物治疗全国重点实验室丁楅森研究员的大力支持。https://www.cell.com/developmental-cell/fulltext/S1534-5807(25)00030-9参考文献
[1] Humbert M, Kovacs G, Hoeper M M, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Eur Respir J, 2023, 61(1).
[2] Hoeper M M, Humbert M, Souza R, et al. A global view of pulmonary hypertension[J]. Lancet Respir Med, 2016, 4(4): 306-322.
[3] Humbert M, Guignabert C, Bonnet S, et al. Pathology and pathobiology of pulmonary hypertension: state of the art and research perspectives[J]. Eur Respir J, 2019, 53(1).
[4] Wakabayashi T, Naito H, Suehiro J I, et al. CD157 marks tissue-resident endothelial stem cells with homeostatic and regenerative properties[J]. Cell Stem Cell, 2018, 22(3): 384-397 e386.
[5] Jiang L, Chen T, Sun S, et al. Nonbone marrow CD34(+) cells are crucial for endothelial repair of injured artery[J]. Circ Res, 2021, 129(8): e146-e165.
[6] Ni Z, Deng J, Potter C M F, et al. Recipient c-Kit lineage cells repopulate smooth muscle cells of transplant arteriosclerosis in mouse models[J]. Circ Res, 2019, 125(2): 223-241.
[7] Liu Q, Huang X, Zhang H, et al. c-kit(+) cells adopt vascular endothelial but not epithelial cell fates during lung maintenance and repair[J]. Nat Med, 2015, 21(8): 866-868.
[8] Ikutomi M, Sahara M, Nakajima T, et al. Diverse contribution of bone marrow-derived late-outgrowth endothelial progenitor cells to vascular repair under pulmonary arterial hypertension and arterial neointimal formation[J]. J Mol Cell Cardiol, 2015, 86: 121-135.
BioART战略合作伙伴
(*排名不分先后)
转载须知
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经作者的允许禁止转载,作者拥有所有法定权利,违者必究。















