前文
《依托考昔为例:适度区分力的溶出方法开发与验证》
(点击阅读全文),承蒙
谢老师点评
,现奉上第二篇印度人的文章。不得不说,印度人的确走在了我们前面。欧美观点的超前思路,太高大上,实在难望项背。相比之下,印度人的做法较易理解,可以立刻模仿接受。其做法值得学习,思路值得借鉴。本文为溶出方法开发的QbD,如有不当之处,请多多指教。
本文基于亲水基质,采用多种型号羟丙甲纤维素(HPMC K4M、K15M和K100M)开发了盐酸文拉法辛(Ven HCl)控释片。
目的是使自制样品的溶出曲线与参比制剂(Effexor XR Capsules)相似(f2>50)。根据FDA使用QbD方法的调释制剂(MR)指南,进行优化处方的溶出曲线研究。
数据显示,最终处方的溶出曲线在不同转速下的多种溶出介质中与 Effexor XR 统计学相似,USP 装置 1 和 2 之间的结果相似。 进行了酒精诱导剂量倾泻研究,结果相当。 这表明该片剂等同于 Effexor XR(微丸包衣)。
关键词
:Effexor XR;亲水基质片剂;溶出;相似因子
文拉法辛
(商品名:Effexor、 Effexor XR、Lanvexin和Trevilor)
,5-羟色胺,去甲肾上腺素和多巴胺再摄取抑制剂(SNRI)类
(1-3)
的抗抑郁药。主要用于治疗抑郁症,一般焦虑症,社交恐惧症,惊恐障碍和血管舒缩症状
(4)
。常规制剂相比,文拉法辛控释制剂能够在更长的时间内产生更低的峰值血浆浓度,研究表明,延缓释放制剂的副作用——恶心,并导致停药,发生概率较低
(5)
。
文拉法辛控释制剂的给药系统是微丸上药,并用乙基纤维素包衣的胶囊剂
(4)
。很多专利
(6-8)
还公开了由乙基纤维素或乙基纤维素和羟丙基甲基纤维素(HPMC)的组合涂覆的 Ven HCl 微丸组成的文拉法辛延释制剂(一日一次)。因为有多个包衣阶段,时间长,每个阶段
(9)
完成后都要检测微丸。车间生产这种多单元颗粒系统(MUPS)是非常昂贵和耗时的。
本文采用 3
3
全因子设计,以具有类似于 Effexor XR 胶囊的溶出曲线为目标,开发了简单的基于亲水基质的片剂。
按照 FDA 针对调释(MR)片剂
(10)
的 QbD 的指导方针,将含有 75mg 文拉法辛的最优片剂处方进行预测性溶出度测试,并与市售的 Effexor XR 胶囊(含有75mg的文拉法新)进行比较。使用相似性因子来统计比较 Effexor XR 和自制片的溶出曲线。
盐酸文拉法辛(Ven HCl)购自 EMCO industries (印度)。Effexor XR(75mg 文拉法辛缓释胶囊)从市场采购。亲水基盐酸文拉法辛控释片自制。磷酸二氢钾,乙酸铵,冰醋酸,乙醇,氢氧化钠(SD Fine Chemicals,印度),盐酸(默克印度),去离子水。
采用
3
3
全因子设计,使用不同黏度级别的 HPMC(K4M、K15M和K100M)及其组合物设计 27 个处方,制备盐酸文拉法辛控释片(含75mg文拉法辛)。Design Expert 9.0.3.1软件(Stat-Ease,Minneapolis,MN,USA)用于绘制响应面和等高线图,确定设计空间。
设计空间如表 1 所示。然后在设计空间内配制优化的处方。表 2 显示优化处方的组成。
生产片剂时,称取 Ven HCl,HPMC K4M,K15M,K100M 和 Avicel PH102(MCC),过 30 目筛,混合 5 分钟。加入 Aerosil(气相二氧化硅)和硬脂酸镁(过60目筛),混合 3 分钟。 压片,12.5mm的凹形圆形片,片重 500mg,硬度 5-7kg/cm
2
。
表1 HPMC优化范围
|
HPMC级别
|
低浓度(%)
|
高浓度(%)
|
|
K4M
|
13
|
15.5
|
|
K15M
|
12.2
|
13.8
|
|
K100M
|
12.2
|
15.4
|
表2 优化的盐酸文拉法辛控释片(含75mg文拉法辛)处方
|
序号
|
名称
|
组成(%)
|
|
1
|
盐酸文拉法辛
|
16.98
|
|
2
|
Avicel PH102
|
40.57
|
|
3
|
K4M
|
14.25
|
|
4
|
K15M
|
13
|
|
5
|
K100M
|
13.8
|
|
6
|
硬脂酸镁
|
1
|
|
7
|
Aerosil
|
5
|
|
总重
|
500mg
|
根据 FDA 针对 MR 片的 QbD 指南,优化该片剂和 Effexor XR 的溶出度测试
(10)
。溶出曲线的对比按照表3进行。
表3 溶出曲线的对比参数
|
序号
|
模拟体内的体外条件
|
溶出介质
|
溶出条件
|
|
1
|
胃肠道pH
|
0.1N盐酸溶液
|
900mL,篮法,50rpm
|
|
pH4.5醋酸盐缓冲液
|
|
pH6.8磷酸盐缓冲液
|
|
水
|
|
2
|
禁食状态
|
0.1N盐酸溶液
|
500mL,篮法,50rpm
|
|
3
|
胃蠕动
|
0.1N盐酸溶液
|
900mL,篮法,25、75和100rpm
|
|
4
|
——
|
0.1N盐酸溶液
|
900mL,篮法/浆法对比
|
|
5
|
乙醇摄入
|
0.1N盐酸溶液,5%、10%、20%和40%乙醇
|
900mL,篮法,50rpm
|
在不同溶出介质(0.1N 盐酸、pH 4.5 醋酸盐缓冲液、pH 6.8 磷酸盐缓冲液、水和不同浓度乙醇的 0.1N 盐酸溶液)中验证紫外分光光度法。通过专属性、线性、精密度、滤纸干扰、安慰剂干扰和溶液稳定性
(11,12)
的验证,以证明分析方法的重现性和可靠性。
计算公式:
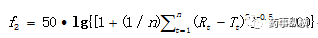
Rt 为 t 时间参比样品平均溶出量;
Tt 为 t 时间受试样品平均溶出量;
n 为取样时间点的个数(13-15)。
相似因子(f2)是在所有时间点上的样品Tt和参比Rt之间差的平方的对数转换。
采用 0.1N 盐酸溶液检测自制样品和 Effexor XR,对比不同乙醇浓度的溶出曲线。结果用 GraphPad Prism software Version 6.05 (San Diego, CA, USA) 进行 T 检验。p<0.05时认为有统计学差异。
采用设计空间内的处方在单一条件下压片。平均片重 500±10mg,脆碎度为 0.42%,含量均匀度 98.9-99.7%。
开发了紫外分光光度法检测盐酸文拉法辛的含量。绘制不同溶出介质(0.1N 盐酸、pH4.5 醋酸盐缓冲液、pH6.8 磷酸盐缓冲液、水和不同浓度乙醇的 0.1N 盐酸溶液)的标准曲线,274nm 检测。
线性范围 0.1 N HCl ,水 10–300 μg/mL,pH 4.5 为 50–350 μg/mL,pH 6.8 为 20–350 μg/mL。5% 乙醇的 0.1N 盐酸为 20–120 μg/mL。其他浓度乙醇的0.1N盐酸溶液为20–140 μg/mL。
在各种溶出介质中测定精密度(日间和日内)。对于重复性和中间精度,RSD不超过5%,表明合适的精度。在不同的溶解介质中无滤纸或安慰剂的干扰,药物在溶液中9h稳定。
初始采用 USP 装置 1 中以 50rpm 在 900mL 不同溶解介质(水,0.1N HCl,pH 4.5 醋酸盐缓冲液和pH6.8磷酸盐缓冲液)中测定 Effexor XR 和自制样品的溶出曲线。检测 24h,溶出曲线见图1。
溶出介质选择的依据是药物口服后时进入胃(pH1.2),3 h后移至十二指肠,小肠上部。餐后时,胃肠道 pH 范围 3.5-5.5。通常,口服给药的 MR 剂型,在进食后暴露于该范围 pH,位于胃和小肠上部。因此,在 0.1N HCl和 pH 4.5 中进行溶出实验分别模拟禁食和进食条件下胃和十二指肠环境,pH 6.8 的溶解介质模拟大肠的pH。水模拟小肠中的环境,在其吸收时药物存在较长时间。计算两种产品之间的相似性因子,分别为水,0.1N HCl,pH4.5醋酸盐缓冲液和pH6.8磷酸盐缓冲液分别为71.90,73.65,61.22和62.55。结果表明,
在所有溶出介质中自制样品与参比制剂统计学溶出相似。
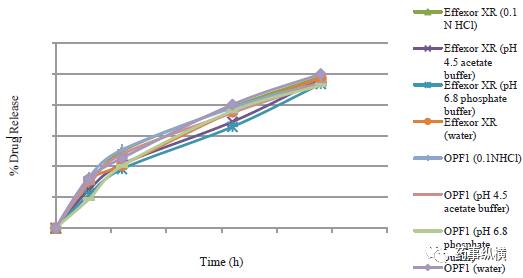
图1 所有溶出介质中自制样品与参比制剂溶出曲线
禁食和餐后条件下,GIT 的体积不同,制剂在体内满足漏槽条件。为了模拟这些生理条件,采用不同体积的溶出介质中进行溶出试验。USP装置1、50 rpm、0.1N HCl(500mL,900mL和1000mL)检测自制样品和参比制剂的溶出曲线。
对于 500mL,900mL和 1000mL,相似性因子分别为74.104、73.65和62.97。
自制样品和参比制剂的溶出曲线相似。体外溶出应模拟人类GIT的生理条件。
25 rpm 模拟胃肠蠕动最慢的转速。75 rpm 是模拟胃肠道可能影响生物利用度的转速。100rpm 是模拟胃肠最快蠕动的转速。
采用装置1,在25、50、75和100 rpm下,900mL溶出介质,相似因子分别为59.15、73.64、64.14 和 62.83。在所有转速下,自制样品的相似因子大于 50。Effexor XR 和自制样品在不同溶出体积、不同转速下的溶出曲线对比如图 2a,b所示。
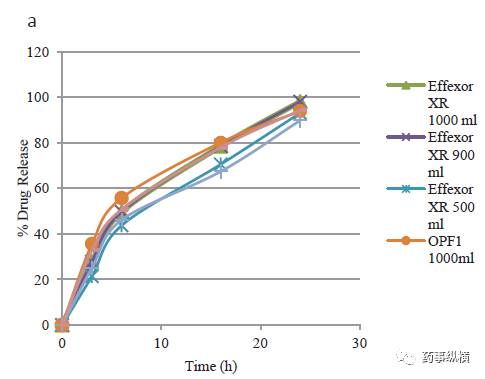
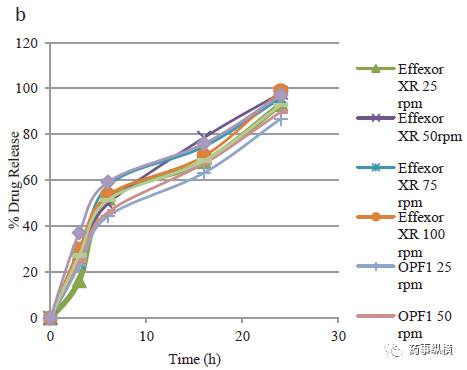
图2 自制样品和参比不同体积(a)和不同转速(b)的溶出曲线对比
通常使用USP装置2进行片剂的体外溶出研究。参比 Ven HCl XR胶囊的官方 USP 方法采用装置1。为了评估自制样品,并确保溶出曲线不会随着装置类型改变。在装置 1 和装置 2 中进行参比制剂的溶出试验。在装置 2 中进行的溶出曲线计算的相似因子为71.645,
这表明即使装置 1 被替换为装置 2 ,自制样品的溶出曲线不会改变,两种仪器均可用于监测自制样品的溶出曲线。
FDA 发布了关于酒精-帕拉多酮相互作用的警戒
(16)
,酒精诱导的剂量倾泻研究是为了确保在酒精存在下自制样品的稳定性。在不同浓度的乙醇(5%,10%,20%和40%)的 900mL 0.1N HCl 的介质中进行4小时的溶出曲线测试。根据FDA指南
(17)
,高达 40%的乙醇暴露不能导致调试制剂的剂量倾泻。正如图 3 所示,溶出介质中酒精浓度的增加溶出速度更快;40%乙醇释放速度快于无乙醇。
计算参比与自制样品的相似因子。溶解介质中不含醇,f2 值为96.22。在 5%,10%,20%和40%酒精存在下,f2 值分别为73.68,76.71,83.89 和 92.03。结果表明,
在溶解介质中的各种浓度的醇中,自制与样品具有类似于参比制剂的溶出曲线,并且在乙醇存在下自制样品药物释放的差异在统计学上不显著(p > 0.05)
。
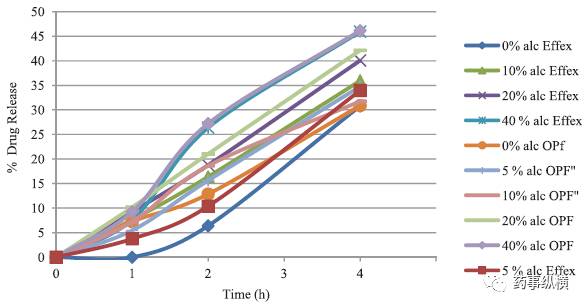
图3 不同浓度的乙醇(5%,10%,20%和40%)的900mL 0.1N HCl的介质中溶出曲线
研究表明,使用亲水基质平台而不是包衣微丸技术(Effexor XR胶囊)制备的控释片在各种条件下具有与 Effexor XR 相似的体外溶出曲线。另外,在含有不同浓度酒精的溶出介质中,自制样品与参比制剂的溶出曲线相似。自制样品在乙醇存在下是稳定的,未显示剂量倾泻。
参考文献:(略)
本文转自药事纵横,由编辑Herman翻译,转发本文仅为学习与交流,如无意触犯版权,请联系小编删除






