
中医药一直我们中华民族的文化瑰宝,是老祖宗留下来的宝贵财富。特别是在近年来的全球公共卫生事件中,中医药在病毒性传染病防治中发挥了重要作用。那么中药如何发生信高分文章呢?那你可算问对人了!生信湾不才,正好对中医网络药理学这块颇有研究,想要上岸网络药理学的宝子们记得联系生信湾哦~
今天生信湾跟小伙伴们分享一篇7分+的中药网络药理学干湿结合文章。
要深入了解这篇高分文章,就紧跟生信湾一起,来探究作者是如何玩转网络药理学的吧!
1.
本研究采用
网络药理学
和分子
对接分析
方法,鉴定了
QLYD(黄芩和黄连)对
动脉粥样硬化(
AS
)
的潜在靶点和通路,确定了
QLYD
治疗
AS
的作用机制,为后续研究奠定了基础。
2.
作者采用了
7
个数据库
预测
QLYD
的活性成分和药物靶点,丰富的数据来源更能获得审稿人的青睐!
3.
此外,研究团队还采用了
动物模型
进行实验验证,进一步确认了
QLYD
抗
AS
的核心靶点和通路。这一实验验证的过程不仅增强了研究的可信度,也使得研究成果更具实际应用价值。
(
ps:
生信湾这里好思路永远不缺,缺的是你不来找我唠嗑,带上你的idea来找生信湾剖析吧~当然,没有idea的也可以找我们哦
~
)
定制生信分析
云服务器租赁
(加微信
备注66
领取试用)
题目:结合网络药理学和实验验证,鉴定黄芩科根瘤治疗动脉粥样硬化的生物活性化合物及潜在机制
杂志:Biomed Pharmacother
影响因子:IF=
7.5
动脉粥样硬化(
AS
)是一种主要累及大、中动脉的全身性疾病,且患者日趋年轻化,对人类健康和生命安全构成极大威胁。黄连是治疗AS的中药复方中常用的核心药物组合,此外,在许多治疗AS的方剂中也可以发现QLYD。因此,本文通过网络药理学、生物信息学、分子对接等手段,在分子水平上系统分析QLYD在AS中的作用机制。
|
数据集/队列
|
数据库
|
详细信息
|
|
黄芩和黄连的有效成分和靶点
|
TCMSP
、Uniport
|
49个有效成分及其225个靶点
|
|
AS的靶点
|
OMIM
、
DrugBank
、
DisGeNET、GeneCards、CTD
|
145、53、239、1221和64个抗AS靶点
|
|
GSE100927
|
GEO
|
481个差异基因
|
作者首先基于TCMSP数据库筛选了QLYD(黄芩和黄连)的有效成分和靶点,利用Cytoscape构建了QLYD活性组分及其靶点的调控网络,基于OMIM、DrugBank、DisGeNET、Gene Cards和CTD数据库中挖掘AS的潜在治疗靶点;
接着,基于GEO数据库中获取正常或动脉粥样硬化的差异基因,对上述基因取交集,最终保留了68个潜在的AS治疗靶点。
利用String构建了一个包含68个节点和1060条边的PPI网络并基于MCC算法确定排名前5的枢纽基因(IL6、VEGFA、AKT1、TNF和IL1B),并利用MCODE插件对上述靶点进行蛋白聚类分析。
随后,作者对上述68个相交靶点进行功能富集分析,以核心成分与核心靶点进行分子对接分析。
最终建立了小鼠AS模型探究QLYD的抗AS作用。
1. QLYD活性成分及其靶点确定
本研究基于TCMSP数据库筛选了QLYD(黄芩和黄连)的有效成分,分别鉴定了14种和37种活性成分,对其进行归一化和靶点分析,最终保留了49个有效成分及其225个靶点。随后利用Cytoscape构建了QLYD活性组分及其靶点的调控网络(图
1
),其中相关度最高的是
槲皮素、汉黄芩素、植物甾醇、黄芩素和延胡索
,此外,据文献报道,小檗碱被广泛用于治疗AS,将其纳入接下来的分析。
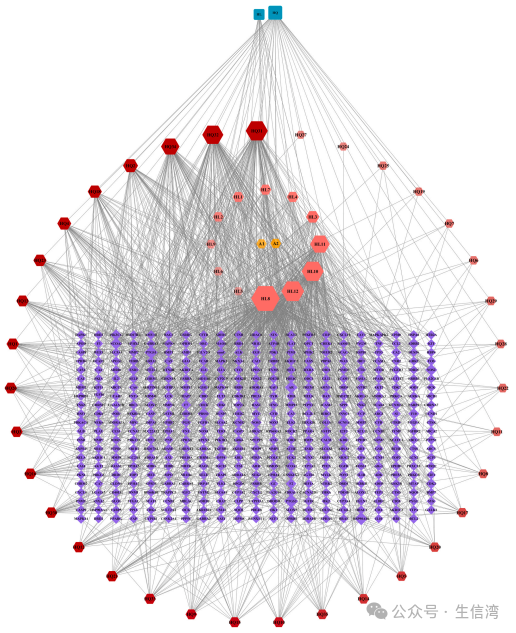
图1 QLYD有效成分与靶点的关系网络
2. QLYD抗AS关键靶点鉴定
作者基于OMIM数据库、DrugBank数据库、DisGeNET数据库、Gene Cards数据库和CTD数据库中挖掘AS的潜在治疗靶点,分别鉴定了145、53、239、1221和64个抗AS靶点;基于GEO数据库中获取正常或动脉粥样硬化的基因表达谱,其中差异上调基因355个和差异下调基因126个(图2A-B);对上述基因取交集,最终保留了
68个相交靶点
(图2C-D)。
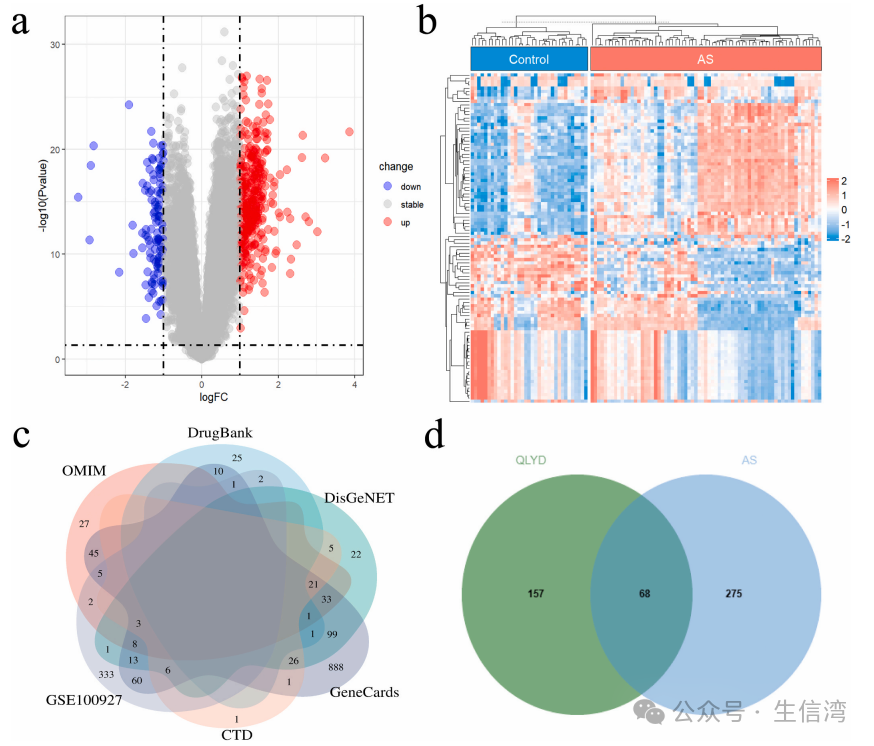
图2 QLYD抗AS关键靶点鉴定
3. 关键靶点PPI网络分析及蛋白聚类分析
利用String构建了一个包含68个节点和1060条边的PPI网络(图
3A),图中节点面积越大,颜色越深,展示了排名前20位的靶点(图3B);作者基于CYTOHUBBA中的MCC算法确定排名前5的枢纽基因(IL6、VEGFA、AKT1、TNF和IL1B)(图3C),并利用MCODE插件对上述靶点进行蛋白聚类分析(图3D),最终得到3个不同的蛋白簇,其中以MMP9蛋白为基础的Cluster1参与了细胞迁移、凋亡信号通路的调控、炎症反应的调控和血管内皮生长因子生成等调控过程;以MAPK14蛋白为基础的Cluster 2参与了血液凝固的正向调节、上皮细胞凋亡过程的调节、活性氧代谢过程的调节和炎症反应等生物进程;以CYP3A4蛋白为基础的Cluster 3参与了外源分解代谢过程、脂肪酸生物合成和代谢过程(图3E)
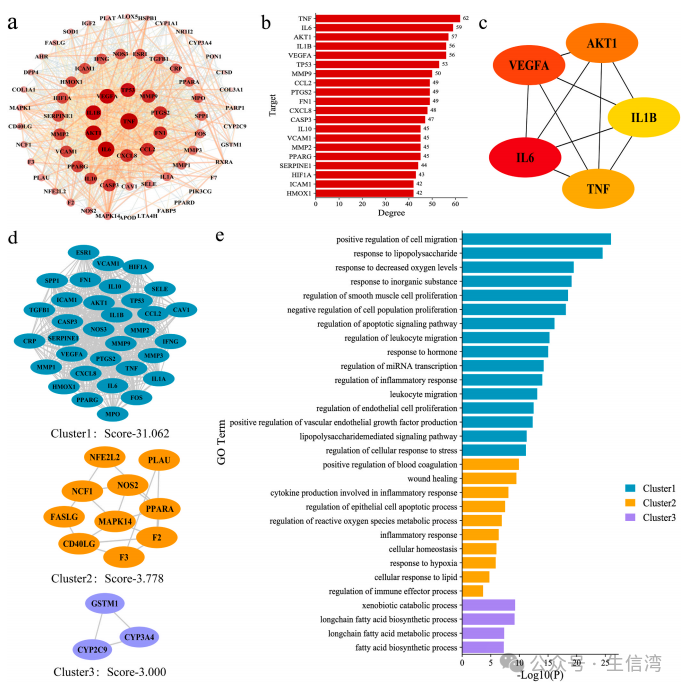
图3 QLYD干扰AS交叉目标的PPI网络分析结果
4. 功能
和通路富集分析
GO富集分析结果表明,上述68
靶点主要富集了对炎症反应的调节、活性氧代谢过程、细胞因子活性和受体配体活性等生物进程(图
4A);KEGG富集结果表明QLYD主要参与了AGE-RAGE信号通路、TNF信号通路、HIF-1信号通路和MAPK等信号通路(图4B)。此外,作者还对排名前50的KEGG通路进行了分类(图4C-D):细胞过程(细胞生长和死亡)、机体系统(免疫系统、内分泌系统、发育和再生)、人类疾病(传染病、心血管疾病、内分泌代谢疾病和免疫疾病)、信号转导(TNF信号通路、HIF-1信号通路、MAPK信号通路和PI3K-Akt等信号通路)。在AS相关通路网络分析中(图4E-F),MAPK1、AKT1、MAPK14、IL1B和FOS排名靠前,QLYD可以通过协调多个通路来治疗AS。
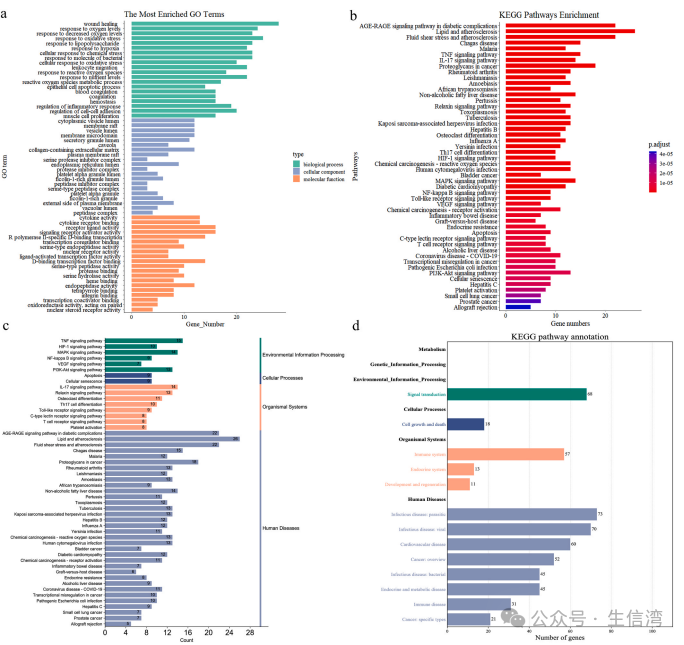
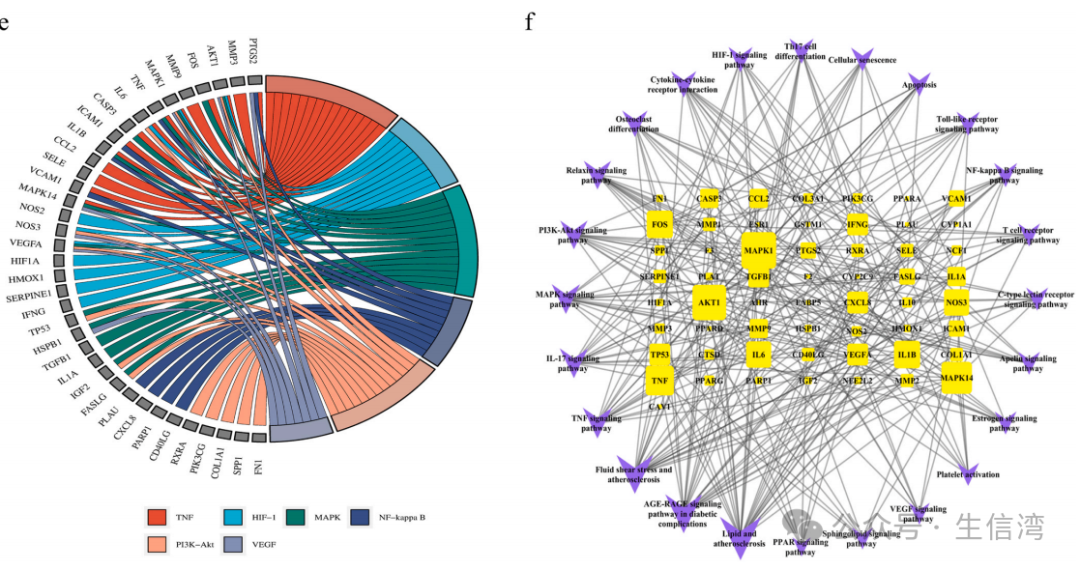
图4 QLYD干预AS交叉靶的GO和KEGG富集分析
5.
分子对接分析
根据以上分析,作者以五大核心成分(槲皮素、汉黄芩素、植物甾醇、黄芩素和延胡索)及小檗碱与IL6、VEGFA、AKT1、TNF、IL1B、MAPK1、FOS等核心靶点进行分子对接分析(图5A)。其中汉黄芩素与FOS结合活性为−9.4;小檗碱与FOS结合活性为−9.0;槲皮素与FOS结合活性为−8.2;小檗碱与AKT1结合活性为−8.2;小檗碱与TNF结合活性为−8.0(图5B-F)。
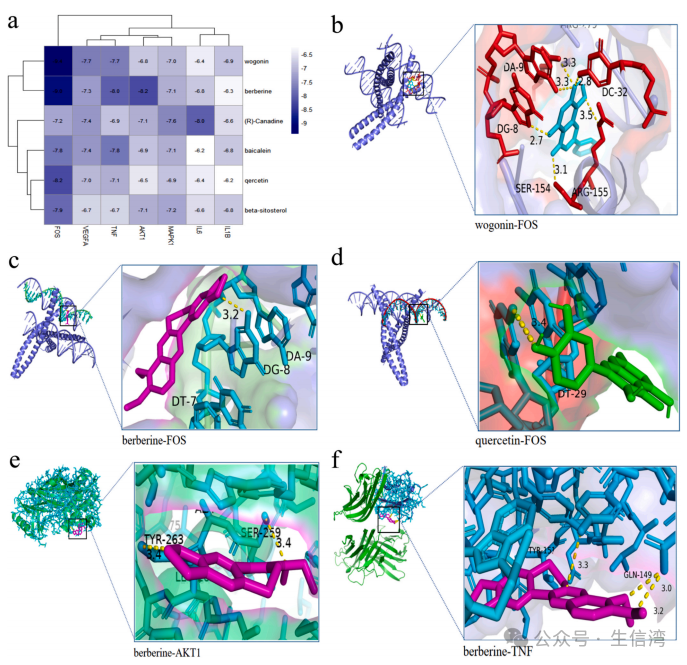
图5 核心靶点与核心成分的分子对接结果
6.
小鼠AS模型验证QLYD作用















