▎药明
康德/报道
今天,Proteon Therapeutics宣布,其在研新药方案vonapanitase已获得美国FDA颁发的突破性疗法认定(BTD),用于血液透析或预期即将进行血液透析的患者群体,
增加动静脉造瘘的次级畅通
(arteriovenous fistula secondary patency)。
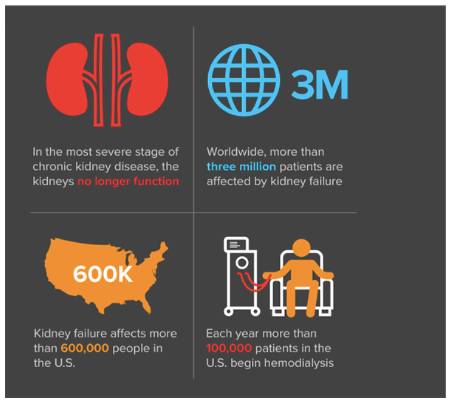
慢性肾脏疾病(CKD)恶化到最严重阶段之时会导致肾衰竭,肾脏不再能维持生命的功能。大多数肾衰竭患者长期采用血液透析,这一治疗方案要求高流量的血管通畅,以将患者的血液重复性地连接到血液透析机上,进而持续性地挽救生命。血液透析过程中,医师优选的血管通路形式为桡动静脉造瘘术(radiocephalic arteriovenous fistula),运用血管外科技术
人为建立一条头静脉连接到前臂远端桡动脉之间的短路,导致血流量和静脉扩张的显著增加
,为血液透析提供长期有效的能进行体外循环的血管通路。
▲
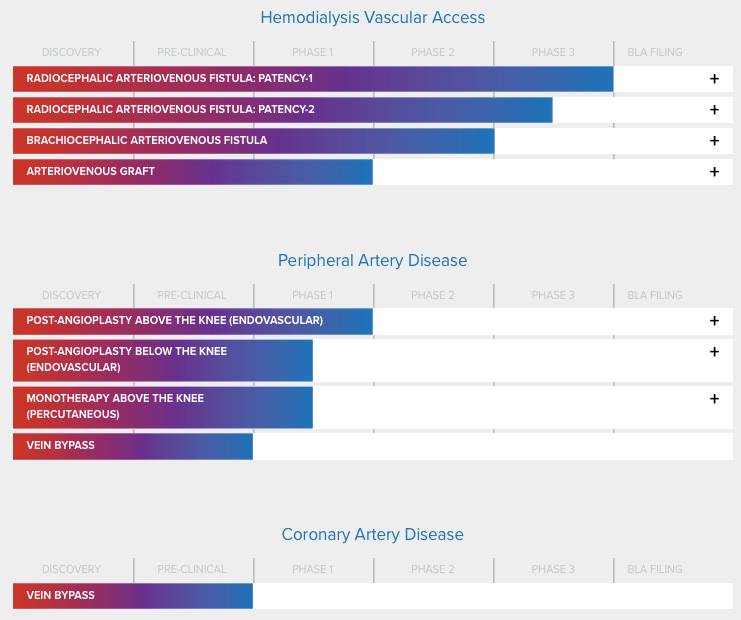
Proteon Therapeutics的研发管线(图片来源:
Proteon Therapeutics
官网)
Proteon Therapeutics致力于通过开发新颖的一流治疗手段来改善肾脏和血管疾病患者的健康。 Proteon的先导候选药物vonapanitase是一种
旨在改善血液透析血管通路的在研新药
。Vonapanitase应用于单次给药,目前正在针对CKD患者进行3期临床计划研究,他们接受了外科手术创建用于血液透析的桡动静脉造瘘。
Vonapanitase已获得FDA颁发的快速通道和孤儿药资格,欧洲委员会颁发的孤儿药资格,用于血液透析血管通路适应症。
Proteon的突破性疗法认定得到
临床研究PATENCY-1的数据支持
。这是该公司的
首个3期临床
试验,用于评估vonapanitase在手术创建桡动静脉瘘CKD患者中的疗效,该临床试验正在进行中。在该研究中,vonapanitase显示出临床上有意义的次级通气和血液透析用途的改善,尽管它没有达到改善原发性通气的主要终点。
PATENCY-2试验的患者招募预计将在2018年第一季度完成,Proteon预计将在2019年第一季度报告相关数据。Proteon还预计将于2019年向FDA提交生物制剂许可申请(BLA)。

▲
Proteon Therapeutics的总裁兼首席执行官Timothy Noyes先生(图片来源:
Proteon Therapeutics
官网)
Proteon Therapeutics公司的总裁兼首席执行官Timothy Noyes先生表示:“我们相信FDA决定向vonapanitase颁发突破性疗法认定,说明了延长造瘘术使用寿命和用于慢性肾脏疾病患者血液透析的临床重要性。我们与FDA正在进行的高效性对话有助于为vonapanitase创造明确的监管道路。我们期待着继续与FDA密切合作,加快我们这一重要计划的开发工作。”
参考资料:
[1]
Proteon
Therapeutics Receives FDA Breakthrough Therapy Designation for Vonapanitase
[2]
Proteon
Therapeutics官方网站







