
第一作者:
Quan-Quan Zhuang
通讯作者:邓豪华,徐莹颖,陈伟
通讯单位:福建医科大学
研究速览
近期,福建医科大学陈伟
教授等人
在Journal of Nanobiotechnology发表了基于双功能CuO NP串联纳米酶的碱性磷酸酶激活前药系统用于按需细菌灭活和伤口消毒的文章。
纳米酶可产生活性氧,是有前途的抗菌剂。然而,ROS在区分正常菌群和病原菌方面本质上缺乏选择性,这使得纳米酶失去了理想抗菌剂所必需的选择性。在此,作者利用细菌的生理条件(高碱性磷酸酶(ALP)表达),使用新型CuO纳米颗粒(NP)纳米酶系统启动ALP激活的ROS前药系统,用于按需精确杀死细菌。前药策略涉及使用2-磷酸-L-抗坏血酸三钠盐(AAP)催化病原菌中的ALP生成抗坏血酸(AA),抗坏血酸(AA)由具有内在抗坏血酸氧化酶和过氧化物酶样的CuO NP转化活动,产生ROS。值得注意的是,该前药系统选择性地杀死大肠杆菌(致病菌),而对人葡萄球菌(非致病菌)的影响最小,因为它们的ALP表达水平不同。与通常在储存过程中消耗ROS的CuO NPs/AA系统相比,CuO NPs/AAP在不影响其抗菌活性的情况下表现出明显更高的稳定性。此外,大鼠模型用于表明CuO NPs/AAP纤维蛋白凝胶在体内伤口消毒中的适用性,且副作用可忽略不计。这项研究揭示了这种双功能串联纳米酶平台在ALP激活条件下对抗病原菌的治疗精度。
要点分析
要点一:
CuO NPs/AAP体系的抑菌活性。在AAP存在的情况下,CuO NPs显著降低了大肠杆菌的VRs,并表现出AAP依赖性的抗菌能力。
要点二:
稳定的CuO NPs/AAP系统用于体外细菌的选择性处理。CuO NPs/AAP系统对高ALP表达菌的有效靶向能力,通过增加菌表面的·OH浓度,减少对低ALP表达菌的损伤,从而显著增强其抗菌效果。
要点三:
CuO NPs/AAP系统体外细胞毒性及溶血试验。CuO NPs/AAP对正常人永生角化细胞(HaCaT)和大鼠心肌(H9c2)细胞系无明显细胞毒性,且对红细胞无明显溶血现象。CuO NPs/AAP体系具有良好的生物相容性。
要点四:
体内伤口愈合使用CuO NPs/AAP纤维蛋白凝胶。CuO NPs/AAP具有促进创面再生的作用,并且CuO NPs/AAP纤维蛋白凝胶具有显著的止血能力,适合用于伤口敷料。
要点五:
组织病理学分析和体内毒性评价。CuO NPs/AAP纤维蛋白凝胶在体内可抑制炎症,刺激新血管形成,促进胶原沉积,且具有良好的生物安全性。
图文导读
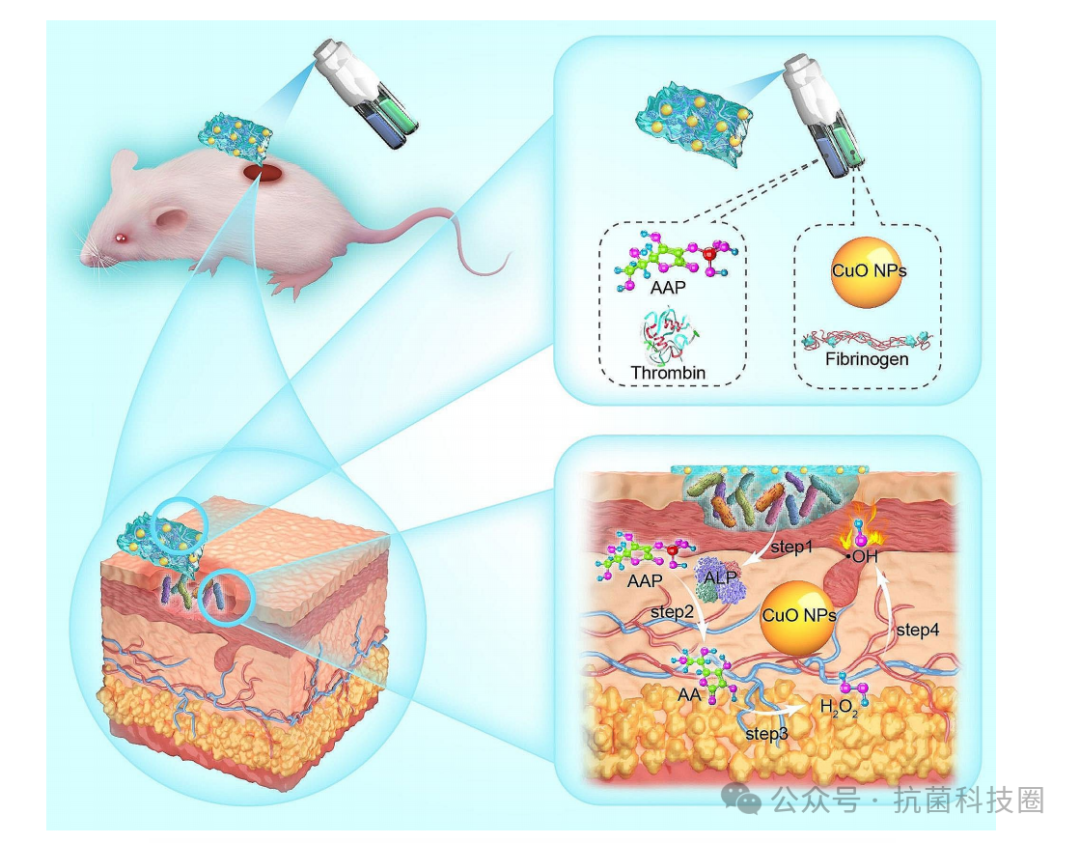
图1:使用氧化铜纳米颗粒/2-磷酸-l-抗坏血酸三钠盐(CuO NP/AAP)作为联合抗菌治疗的前药系统。
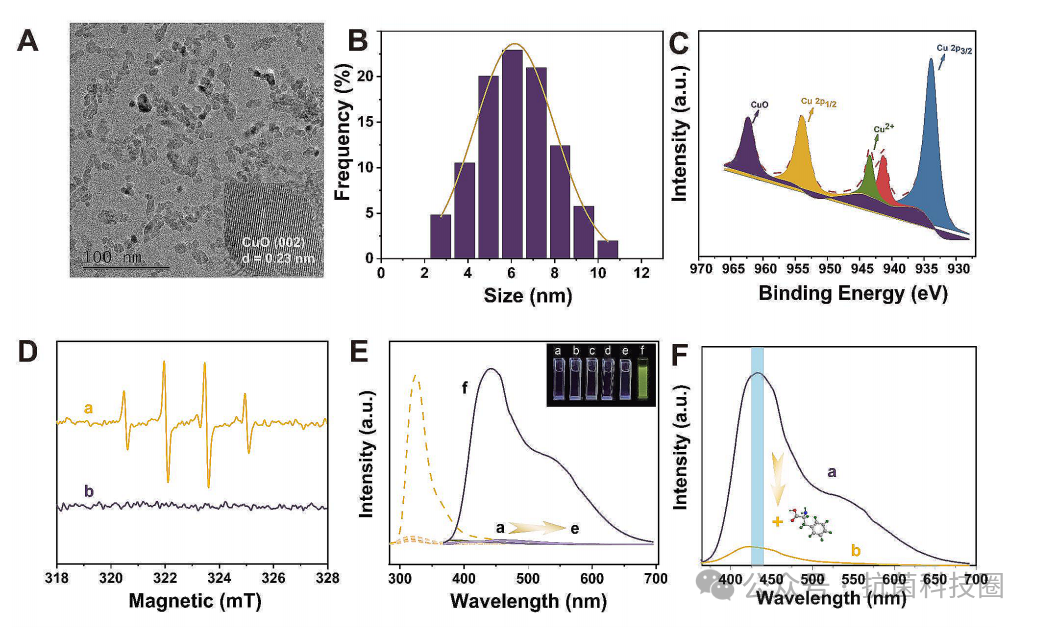
图2:(A) CuO
NPs的典型TEM图像。(B) TEM图像对应的尺寸分布。(C) CuO NPs的XP谱。(D)磷酸缓冲液(20 mM,pH=7.4)中CuO NP-AAP-ALP(a)和CuO NP-AAP (b)的电子自旋共振(ESR)谱图。(E) (a) TA-CuO NP-AAP,(b) TA-ALP,(c) TA-AAP,(d) TA-CuO NPs,(e) TA,(f) TA-CuO NP-AAP-ALP在0.02 M PBS(pH=7.4)中的光激发和光发射光谱,插图显示了荧光。(F) (a) TA-CuO NP-AAP-ALP和(b) l-苯丙氨酸加入到CuO NP-AAP-ALP基团后TA-CuO NP-AAP-ALP的光电发射光谱。
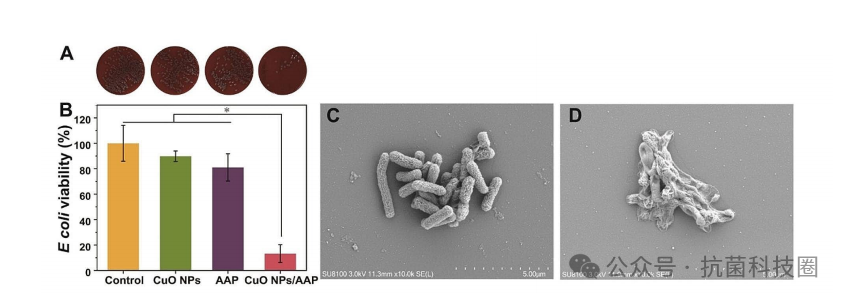
图3:(A)用水、2-磷酸-l-抗坏血酸三钠盐(AAP)、氧化铜纳米颗粒(CuO NPs)和CuO NPs/AAP体系孵育的大肠杆菌菌落。(B)用水、CuO NPs(0.3µg mL
-1
)、AAP (1.7 mg mL
-1
)或CuO NPs(0.3µg mL
-1
)/AAP(1.7 mg mL
-1
)处理后的细菌细胞活力测定。误差条表示标准差(n=3)。*p<0.05。大肠杆菌与水(C)或CuO NPs/AAP(D)孵育20小时后的SEM图像。
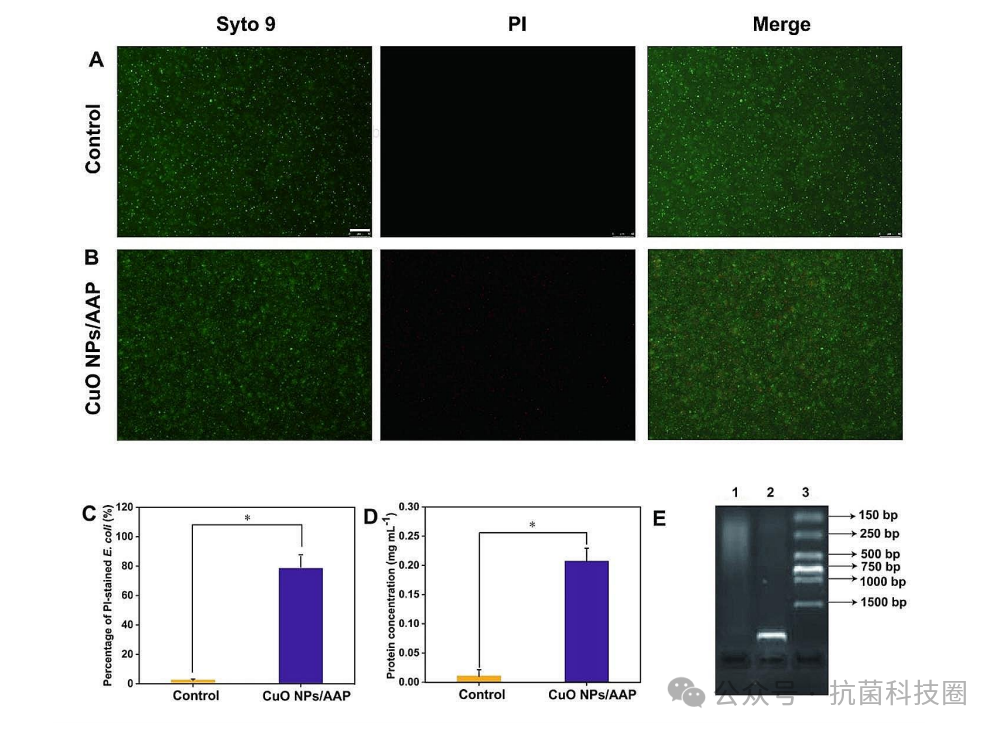
图4
:细菌细胞经水(A)或CuO NPs/AAP(B)处理20 h后的荧光图像。碘化丙啶(PI)染色(红色)显示死亡细胞,Syto 9(绿色)有助于识别所有细胞。标尺尺寸为50 μm。(C) PI染色的大肠杆菌显示菌膜受损的百分比,*p<0.05。(D)处理20 h后对大肠杆菌细胞用Bradford法进行蛋白渗漏分析,*p<0.05。(E)提取基因组DNA琼脂糖凝胶电泳结果。1-3分别对应CuO NPs/AAP、水处理和标记物。
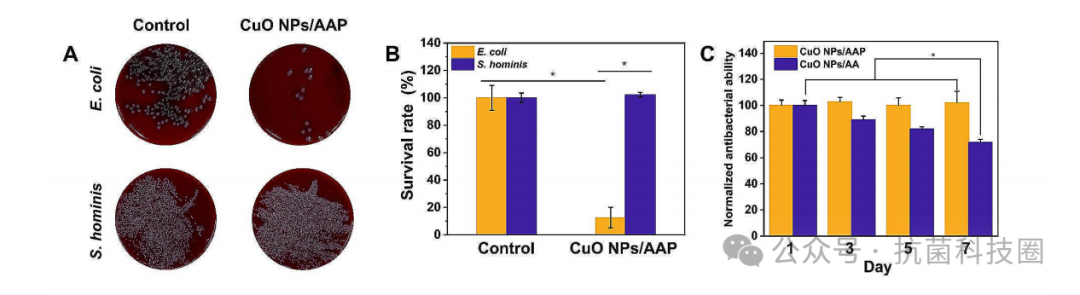
图5:(A)不同处理条件下ALP表达特性不同的菌落图像。(B)CuO NPs(0.3µg mL
-1
)/AAP(1.7 mg mL
-1
)体系对ALP表达较高或较低的细菌的相对杀菌活性,*p<0.05。(C) CuO NPs(0.3 µg mL
-1
)/AAP(1.7 mg mL
-1
)和CuO NPs(0.3µg mL
-1
)/AA(1.7 mg mL
-1
)的抗菌稳定性,*p<0.05。
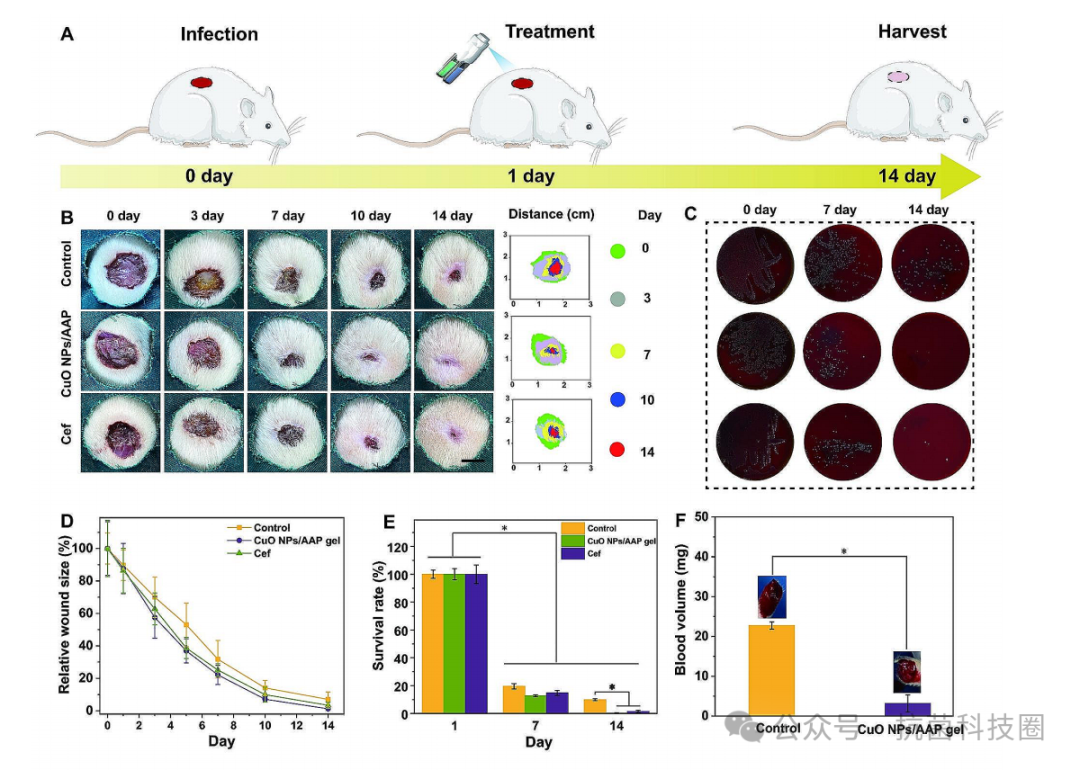
图6:(A)大肠杆菌感染大鼠体内皮肤再生示意图。(B)水或CuO NPs/AAP纤维蛋白凝胶在第0,3,7,10和14天处理的大鼠感染伤口区域的代表性图像和痕迹。(C)用水、CuO NPs/AAP纤维蛋白凝胶或头孢曲松(cef)孵育后0,7和14天,携带感染皮肤组织大肠杆菌菌落的血琼脂板图像。(D)水、CuO NPs/AAP纤维蛋白凝胶或cef处理后0,3,7,10和14天的伤口闭合率。(E)活菌大肠杆菌的相应统计分析,*p<0.05。(F)对照组和CuO NPs/AAP纤维蛋白凝胶止血研究,*p<0.05。
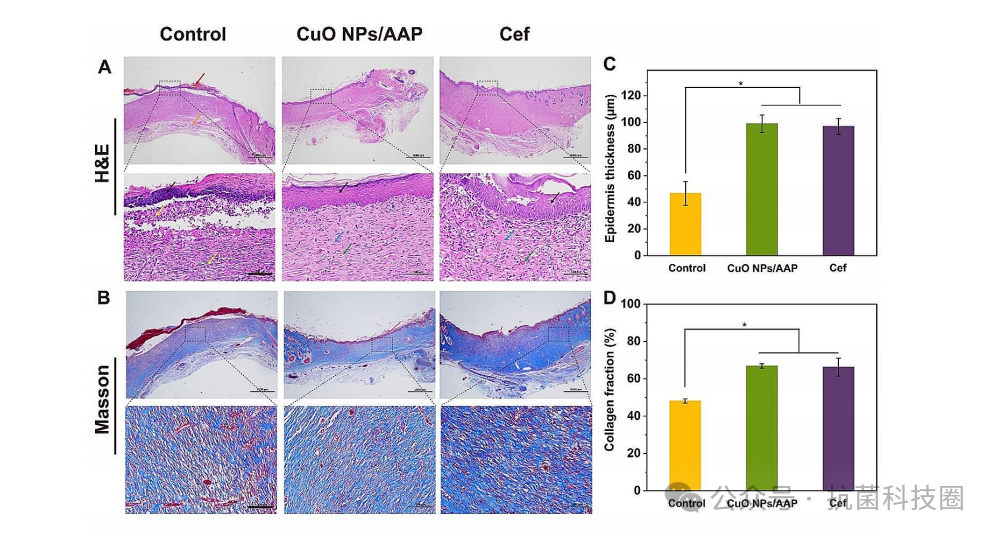
图7:不同处理对大肠杆菌感染皮肤组织的组织学分析:(A)水、CuO NPs/AAP纤维蛋白凝胶或头孢曲松(cef)处理14 d后大肠杆菌感染部位的苏木精伊红(H&E)和马松三色(MT)染色。比尺为100 μm(C)处理14 d后各组上皮厚度,*p<0.05。(D)治疗14 d后各组胶原体积分数,*p<0.05。
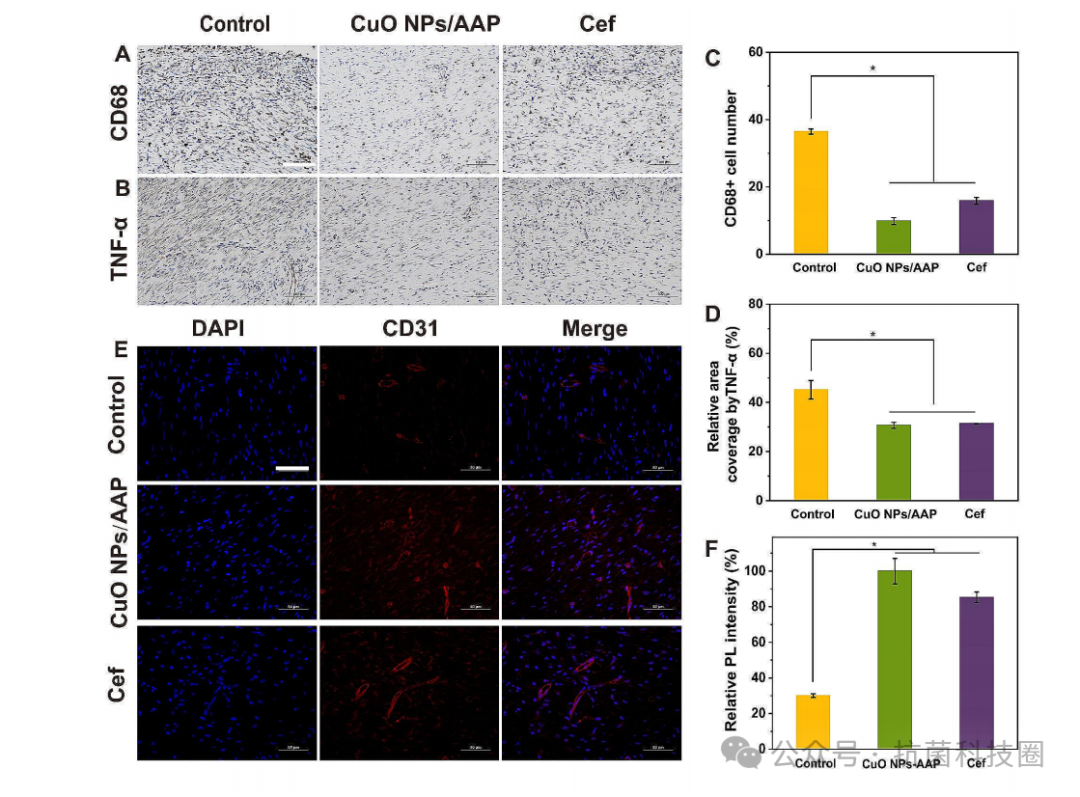
图8:对照组、CuO NPs/AAP纤维蛋白凝胶组和头孢曲松(cef)组CD68 (A)和TNF-α (B)免疫组化图像。标尺尺寸为100 μm。(C)处理后第14天CD68
+
细胞的平均数量,*p<0.05。(D)定量分析皮肤创面新生组织中TNF-α含量,*p<0.05。(E)伤口组织中CD31(红色)和细胞核(蓝色)的代表性免疫荧光图像。标尺为50 μm。(F)创面组织CD31荧光强度定量,*p<0.05。
结论
在本研究中,基于双功能氧化铜纳米酶平台制备了一种ALP激活的前药系统,用于按需精确杀灭细菌。这种高效的抗菌系统被证明可以降解细菌膜并破坏DNA结构。此外,与CuO NPs/AA体系相比,CuO NPs/AAP体系具有较高的·OH生成率和抗菌性能。与基于ROS的传统体系相比,AAP对CuO NPs具有很高的耐受性,而CuO NPs不能像AA那样直接催化底物生成·OH。同时,CuO NPs/AAP对低ALP表达的细菌和健康细胞保持无害。此外,由CuO NP纳米酶、AAP、纤维蛋白原和凝血酶合成的纤维蛋白凝胶具有生物相容性,可调节抗炎止血细胞因子和生长因子。它还可以进一步加速体内感染伤口的愈合,对主要器官的副作用可以忽略不计。今后应继续研究提高细菌ALP的活性,以提高抗菌效率。综上所述,作者提出的药物前策略为解决传统CuO NPs/AA体系的不稳定性和过早激活的矛盾提供了一种合适的方法,并揭示了利用ALP作为引发剂开发按需抗菌药物的潜力。
全文链接
:
https://doi.org/10.1186/s12951-024-02751-7
参考文献:
Quan-Quan Zhuang,Zhi-Shan Zhang,Ting-Jin Zheng,Lin-Yan Lu,Meng-Ting Lin,Jia-Lin Yang,Hao-Hua Deng,Ying-Ying Xu,Wei Chen,
Journal of Nanobiotechnology (2024)22:485.
DOI:10.1186/s12951-024-02751-7
投稿联系:
[email protected]
欢迎各位抗菌同仁进群交流(抗菌科技圈)!
由于群人数已满200,各位业界同仁可以添加小编微信(wei315317或xb_15273285712)邀请进群
。





