细菌耐药性的产生以及对应的解决方法一直以来是微生物学基础研究与临床治疗领域十分热门的话题。针对近期这一领域的研究进展,进行简要的盘点,希望读者朋友们能够喜欢。

1. Mol Cell:特殊DNA运输技术或可有效攻克耐药性细菌的感染
DOI: 10.1016/j.molcel.2017.04.025
抗生素耐药性是目前威胁全球公众健康的主要隐患,其会影响到任何人的健康;如今每年70万人的死亡都归因于抗生素耐药性,2050年这一数字将会增长至1000万;近日,一项刊登在国际杂志Molecular Cell上的研究报告中,来自以色列特拉维夫大学的研究人员通过研究成功促进DNA运输到耐药性细菌病原体中,从而就能够有效对病原菌的耐药性进行操控。
文章中,研究人员重点对噬菌体进行了研究,其是一种主要的研究工具,能够将DNA运输到病原菌中来中和病原菌的致死活性;单一类型的噬菌体能够适应多种类型的细菌,因此其或许能够作为一种创新性的工具来帮助研究人员加速开发治疗耐药性细菌感染的潜在药物。
研究人员通过对噬菌体进行遗传性修饰使其包含研究者所想要的DNA,同时研究者还设计出了来自不同噬菌体的纳米颗粒组合,其就能够更加有效地识别新型细菌,包括多种病原菌等,随后研究者利用定向进化的方法选择出了杂交颗粒来使其运输进行过最佳优化的DNA。Qimron教授说道,对病原体DNA的操控包括使其对抗生素敏感、杀灭病原体、促进病原体失去毒力因子等;如今我们所开发的新技术就能够明显将DNA运输技术扩展到对细菌病原体的研究中,这或许是一项里程碑式的研究,因为研究者实现了对细菌DNA的操控,这在此前研究中或许都是无法完成的。
本文研究或为研究人员改变人类微生物组提供了新的思路,即利用无毒力病原体来替代毒力病原体,以及利用抗生素敏感细菌来替代耐药细菌,未来研究人员将会为这项新技术申请专利,同时利用该技术开发新型产品来将特殊DNA运输到细菌病原体中,从而阻断细菌的毒性,并且使其对抗生素变得敏感。
2. Cell:突破性成果!科学家发现能有效抵御耐药性细菌感染的新型抗生素-pseudouridimycin
DOI: 10.1016/j.cell.2017.05.042
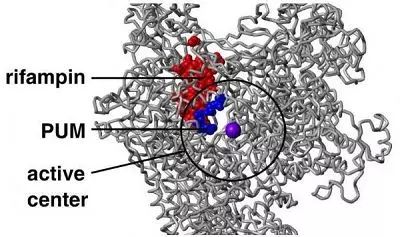
近日,一项刊登在国际杂志Cell上的研究报告中,来自美国罗格斯大学等机构的研究人员通过研究发现了一种能够有效抵御耐药性细菌的新型抗生素-pseudouridimycin,这种抗生素由来自土壤样本中的微生物所产生,通过在测试管中进行试验,这种新型抗生素能够杀灭一系列药物敏感性和耐受性的细菌。
文章中,研究人员报道了这种新型抗生素pseudouridimycin的作用及机制;该抗生素能够通过一种结合位点来抑制细菌细胞中RNA聚合酶的功能,但其作用机制并不同于当前所使用的抗生素-利福平;因为pseudouridimycin能够通过一种不同与利福平的结合位点来抑制细菌生长,因此该抗
生素往往不会促进细菌产生与利福平的交叉耐药性。
抗生素pseudouridimycin起着细菌RNA聚合酶核苷类似物抑制剂的作用,也就意味着其能够模仿三磷酸核苷(NTP),而NTP是细菌RNA聚合酶用来和成RNA的基本结构原件,这种新型抗生素能够通过占领NTP结合位点同细菌RNA聚合酶上的该位点紧密结合,从而抑制NTPs的结合。该抗生素是首个核苷类似物抑制剂,其能够选择性地抑制细菌RNA聚合酶的功能,但对人类机体RNA聚合酶并无影响。
研究者Richard H. Ebright说道,因为细菌RNA聚合酶的NTP结合位点几乎拥有和人类RNA聚合酶相同的结构和序列,很多研究人员都认为这不可能作为核苷类似物抑制剂抑制细菌RNA聚合酶的结合位点(并非是人类细胞的RNA聚合酶);但研究者发现,抗生素pseudouridimycin含有一种侧链,其能够到达NTP结合位点的外部,并且同细菌RNA聚合酶中存在的临近位点相结合,相比人类RNA聚合酶而言,最终新型抗生素就能同细菌RNA聚合酶紧密结合。实际上,pseudouridimycin作为一种核苷类似物抑制剂还能够帮助解释该化合物引发的耐药率较低的原因。
这种新型抗生素能够同NTP结合位点的必要残基相互作用,在没有失去RNA聚合酶活力和细菌活性时NTP结合位点并不会发生改变,对NTP结合位点的改变就能够干扰其同新型抗生素的结合,从而干扰RNA聚合酶的活力,诱发细菌死亡,但并不会引起细菌产生耐药性。研究者Stefano Donadio表示,选择性抑制病毒核苷酸聚合酶的核苷类似物抑制剂或许还会对HIV和丙肝的治疗带来突破性的变革,抗艾滋病的药物齐多夫定、扎昔他宾等都是核苷类似物抑制剂,丙肝药物索非布韦等也是此类抑制剂。
最后研究者表示,本文研究发现阐明了利用天然化合物来治疗疾病的重要性,微生物具有数亿万年的历史,其往往能够产生有效杀灭其它微生物的特殊"化学武器",因此深入探究微生物所产生的天然化合物或许也是未来开发治疗耐药性细菌感染的一个新方向。
3. Nat Commun:科学家们找到细菌产生抗生素耐药性的根源
doi:10.1038/ncomms15784
随着越来越多的细菌对抗生素产生了耐药性,寻找其耐药性产生的根源便成了当务之急。在来自丹麦的科学家们作出的一项最新研究中,他们找到了细菌产生抗生素耐药性的原因,而负责这一活性的基因与产生抗生素的基因本身竟然存在同源性!
抗生素存在多种不同的类型,但它们的作用基本上是
相同的:它们都能够干扰细菌的正常生长与维持,从而达到杀伤细菌的目的。
抗生素本质上是某种细菌抵抗其它细菌物种的武器,而如今我们使用的抗生素大多是来自于一种叫做放线菌的革兰氏阳性菌。
1973年,科学家们发现在放线菌中以及格兰仕阴性细菌中存在微妙的种群数量平衡的现象,进一步,他们发现两种微生物内部均存在能够水解来自另外物种的抗生素的酶。
那么,这些抗性基因最早是怎么出现的呢?
在大多数情况下,这些抗性基因并不会在超级细菌中演化,它们是通过横向的基因转移的方式从一个菌种传播到另外一个菌种中去的。
一些情况下,距离较近的细菌会相互吞噬彼此的遗传物质,主要以质粒传递的方式发生。随着相似的抗生素耐药性机制分别在格兰仕阴性菌以及放线菌中被发现,研究者们提出了"生产者假说",即放线菌是众多细菌产生抗性基因的源头。由此,研究者们进一步观察了一些病原菌中的抗性基因的相似性,他们发现很多不同类型的细菌共享一个相同的抗生素抗性系统。
"半个世纪以前,我们已经怀疑病原菌能够从放线菌获得抗性基因。如今我们找到了两个完全一致的基因"。该文章的作者Xinglin Jiang说道。
事实上,革兰氏阴性菌与放线菌存在很多区别,因此难以想象基因在两者之间的跳跃。 此外,虽然两个基因存在清楚的相似性,但由于还是存在一定的区别,因此还不足以说明两个基因是通过横向传递获得的,而非演化而来的。
而通过对DNA序列进行检测,研究者们证实了这一猜想。
作者们称这一过程叫做"带回模型",即病原菌会利用其注射系统将DNA序列导入临近的放线菌中,之后来自放线菌的抗性基因则与注入序列发生整合。当放线菌死亡之后,遗传物质将会释放到环境中,而另外一个病原菌则会识别该序列并再次吸收为己用。
这相当于将一个空的信封塞到某人的信箱里面,然后等待信箱的主人将信件塞到信封里。你所要做的就是等待主人家的房子倒塌,你就可以进去寻找那封信了。
找到这一抗性基因产生的源头有助于我们针对性地杀伤超级细菌。
"我们或许不能阻止基因的传递,但当我们了解抗性基因在病原体中是如何传递的,那么就有助于开发针对性的疗法"。
相关结果发表在《Nature Communications》杂志上。
4. ASM2017:来自酸奶的一种乳酸杆菌抑制多种耐药性细菌生长
根据来自美国霍华德大学的研究人员在新奥尔良市举行的2017年美国微生物学会(American Society for Microbiology, ASM)年度会议上发布的研究结果,从酸奶中提取出的一种乳酸杆菌Lactobacillus parafarraginis KU495926阻止从位于美国华盛顿特区的一家医院的被感染者体内获得的14种多药耐药性细菌和所谓的超广谱β-内酰胺酶(extended spectrum beta-lactamase, ESBL)细菌生长。
ESBL细菌产生β-内酰胺酶,从而让它们对某些广谱抗生素产生耐药性。这些研究人员发现作为一种革兰氏阳性菌,L. parafarraginis产生一种类似细菌素(bacteriocin,一种抗菌蛋白)的物质,它抑制革兰氏阴性的ESBL病原菌和多药耐药性病原菌生长。根据霍华德大学Broderick Eribo实验室研究生Rachelle Allen-McFarlane的说法,这可能是革兰氏阳性菌来源的细菌素抑制革兰氏阴性菌生长的为数不多的例子之一。
Allen-McFarlane告诉《科学家》杂志,通常而言,来自一种特定菌株的细菌素仅能够抑制密切相关的菌株生长。她解释道,在大多数时间里,"革兰氏阳性菌杀死革兰氏阳性菌"。
她说,"我的关注点是鉴定出来自乳酸菌的能够抑制多药耐药性革兰氏阴性菌和ESBL革兰氏阴性菌生长的细菌素。"
为了研究L. parafarraginis产生的代谢产物是否能够抑制ESBL细菌和多药耐药性细菌生长,这些研究人员首次证实源自L. parafarraginis的代谢物能够阻止体外培养的这些病原菌生长。一经证实这是可行的,他们就利用流式细胞仪和荧光显微镜验证他们的发现。这些实验揭示出当将某些病原菌(包括伤口来源的大肠杆菌)添加到含有L. parafarraginis代谢物的培养基中时,它们的生长受到显著抑制。
接下来,这些研究人员利用PCR技术在L. parafarraginis中鉴定出4种细菌素结构基因,并且作为最后一步,证实这种细菌确实能够表达这些细菌素。
Allen-McFarlane说,在未来,她希望鉴定出L. parafarraginis产生的特定细菌素,并且证实它如何能够抑制众多亲缘关系比较远的病原菌。
根据Allen-McFarlane的说法,产生细菌素的细菌当前作为抑制病原菌生长的食品添加剂被广泛地用于食品行业。但是它们并没有广泛地用于制药行业。
这种情形可能会发生改变。Allen-McFarlane说,一些科学家们认为细菌素可能是未来的抗菌剂。"鉴于抗菌剂耐药性及其对人类生存造成的巨大威胁,我们需要开始研究细菌素。"
5. AJRCCM:突破!开发出治疗抗生素耐药性细菌感染的新疗法
DOI: 10.1164/rccm.201603-0599LE.
日前,一项刊登在国际杂志the American Journal of Respiratory and Critical Care Medicine上的研究报告中,来自伯明翰大学和纽卡斯尔大学的研究人员通过研究开发了一种治疗抗生素耐药性细菌感染的新型疗法。文章中,研究者发现,利用一种不寻常的方法从血液中移除抗体就能够降低细菌慢性感染的副作用、患者住院的时间以及抗生素的使用。
这项研究中,研究者鉴别出了两名遭受铜绿假单胞菌慢性感染的支气管扩张症患者,其中一名患者为64岁男性,其在十五岁时被诊断为支气管扩张症,另外一名患者未69岁女性,其儿时就患有支气管扩张症;铜绿假单胞菌对多种抗生素都有耐药性。支气管扩张症能够诱发肺部气管永久性的扩张,其仅在英国就影响着30万患者的健康,患者主要症状表现为慢性咳嗽、呼吸短促、咳血以及胸疼。
慢性的铜绿假单胞菌肺部感染常常发生于支气管扩张症患者机体中,研究者Ian Henderson解释道,这些患者通常血液中都含有过量特殊的抗体,相比正常状况下抗体相关的保护效应而言,在这些患者机体中,这些抗体会阻断机体免疫系统杀灭铜绿假单胞菌的能力,同时还会使得患者机体肺部的疾病恶化,因此研究人员决定通过研究去除患者机体中的这些特殊的抗体,来观察患者后期的表现情况。
研究者认为,他们需要一种新方法来解决支气管扩张症患者的健康问题,随后研究人员同从事肾脏和免疫学研究的科学家们进行合作,利用血浆去除术来进行后期更为深入的研究,血浆去除术包括从循环系统中移除、治疗并且返回等过程,患者每周要进行5次治疗来移除血液中的特殊抗体,随后研究者从献血者机体中也移除了这些抗体,这种新型疗法就能够帮助患者机体恢复杀灭铜绿假单胞菌的能力。
研究者Henderson表示,所有的患者都能够快速恢复机体健康,而且能够更加独立地完成一些事情,同时其活动能力也得到了改善。基于本文研究,研究人员就能够利用这种新方法来明显改善患者的生存状况,下一步研究者将会进行更长期的研究来调查是否早期干预,同时进行并不激进的疗法能够帮助抑制患者疾病的进展。
最后研究者说道,这项研究中我们首次描述了对细菌感染性疾病的抗体依赖性增强疗法,当然其或许能够应用到其它细菌感染的治疗中,也有望作为新型疗法来治疗某些抗生素耐药性的感染。
6. 中国科学家开发出快速检测耐药细菌的新方法
碳青霉烯类抗生素是最后的抗生素之一,能够对抗许多其他药物无效的感染。然而耐受碳青霉烯类的病原体早在数十年前就产生了。为了确定一种病原体是否具有清除碳青霉烯类抗生素的酶(碳青霉烯酶),中国科学家开发了一种基于荧光探针和光学检测的简单快捷的方法,他们在Angewandte Chemie杂志上介绍他们的最新成果。
碳青霉烯类抗生素是一类和头孢菌素、青霉素相似的beta-内酰胺抗生素。尽管一些细菌株可以通过产生beta-内酰胺酶抵抗beta-内酰胺抗生素,但是大多数beta-内酰胺酶不能影响碳青霉烯类抗生素的功能。因此这些抗生素也被称作最后的抗生素,它们是治疗几种严重疾病的有效药物,如由耐药菌引起的尿道感染、腹腔感染及住院导致的肺炎等。但是越来越多的证据表明有部分细菌可以产生碳青霉烯酶导致耐药。现在,来自华东理工大学的谢贺新及其团队开发了一种新策略,可以检测出携带碳青霉烯酶的病原体。
研究人员合成了一种和碳青霉烯具有相同结构的物质,但是给它键合了一个荧光染料。如果这种碳青霉烯类似物(CVB-1)被细菌提取液中的碳青霉烯酶识别,CVB-1就会被切割并分解。当染料与碳青霉烯的电子相互作用由于切割而消失时,染料就会变成绿色荧光分子,这意味着如果用一定波长的光照射,这些分子就会发绿色光。因此检测的方法如下:如果细菌提取液中有碳青霉烯酶,一段时间后样品就会在特定波长下发出绿光。
这项技术允许我们通过荧光检测细菌的抗生素耐药性。因此使用这种基于荧光的检测系统,医生可以在极短的时间里检测出感染是否是由碳青霉烯耐药菌引起的。医生就可以据此结果给出更个性化的治疗,防止无效药物的过度使用。科学家们进行了几项试验证明了他们的CVB-1测试具有特异性,并且检测极限很低,可以用于活体检测。这种基于荧光的简单快捷的检测方式是一种应对日益严重的抗生素耐药菌的出色检测手段
7. WHO:12大耐药性细菌排名公布
鉴于目前严峻的细菌耐药性趋势,世界卫生组织发表了世界上最具耐药性的、最能威胁人类健康的"超级细菌"列表。
这种"十二恶菌"涵盖了12种不同科目的具有抗生素耐药性的细菌类型。抗生素耐药性每年造成70万人的死亡,如果这一现象无法解决的话,专家们预测2050年每年的死亡人数将会达到1000万人。









