
Trends in Immunology 2021
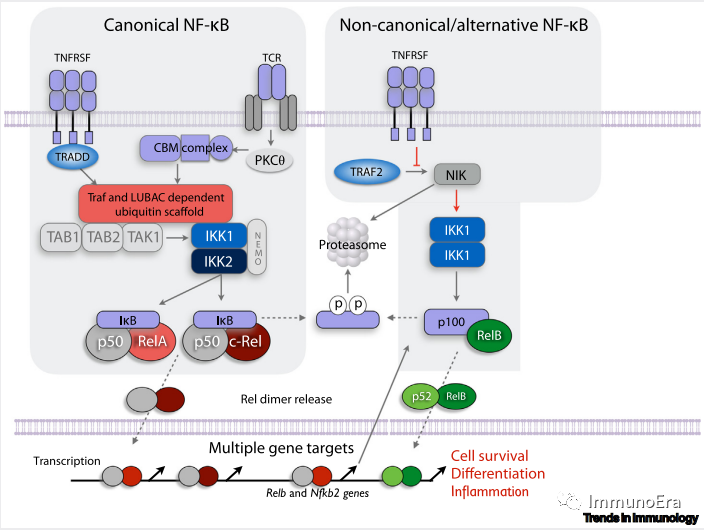
NF-κB转录因子家族是Rel家族成员蛋白的异源或同源二聚体,其中有5个在小鼠和人类之间是保守的(RelA、c-Rel、p50、RelB和p52)。
Rela
、
Rel
和
Relb
基因分别编码Rela、c-Rel和Relb蛋白,
Nfkb1
和
Nfkb2
基因编码p105和p100蛋白,其裂解产物是p50和p52。一种抑制蛋白家族:IκB(包括p105和p100),与Rel二聚体结合,并将其隔离在细胞质中。NF-κB二聚体的释放,在小鼠和人类中受到大致相同的方式调控。IKK复合物是由两个激酶IKK1(IKKα)和IKK2(IKKβ)加上一个调节亚基Nemo(IKKγ)组成的三聚体复合物,它
磷酸化IκB
,导致其被
蛋白酶体降解
,并允许NF-κB二聚体进入细胞核。
该通路调控
RelA:p50
和
c-Rel:p50
NF-κB二聚体的激活,并被IκBα或p105隔离,被称为
典型的NF-κB通路
。
RelB:p52二聚体的活性受到所谓的
替代NF-κB
途径的调控。二聚体被p100蛋白特异性隔离,该蛋白的磷酸化和降解由IKK1同型二聚体组成的IKK复合物特异性控制。而这个IKK1复合物的激活是由NF-κB诱导激酶(NIK)触发的。
表面受体通过各种机制与典型的NF-κB通路相连接。
E3泛素连接酶都有共同的修复点,允许创建泛素支架,这种支架对TAB1/2/TAK1复合物的募集和激活至关重要,进而激活IKK复合物。
在T细胞受体触发后,PKCθ磷酸化Card11,允许进一步招募BCL10和MALT1分子,形成大的多聚CBM复合物。E3泛素连接酶,肿瘤坏死因子受体(TNFR)相关因子(TRAF)-6的募集,导致了泛素支架的产生。
许多TNFRSF蛋白具有TRAF相互作用的基序,可以直接招募TRAF蛋白。除了TRAF6,TRAF 2、3和5还具有E3泛素连接酶活性,创建泛素支架,招募TAB1/2/TAK1和IKK复合物。
其他TNFRSF成员,如TNFR1和DR3,缺乏TRAF相互作用的基序,而是有死亡域,允许招募适配器(如TNFR1相关死亡域蛋白,TRADD),进而可以结合和招募TRAF。相比之下,替代途径的激活是由于TRAF2/3抑制NIK蛋白降解。
Front. Immunol 2021
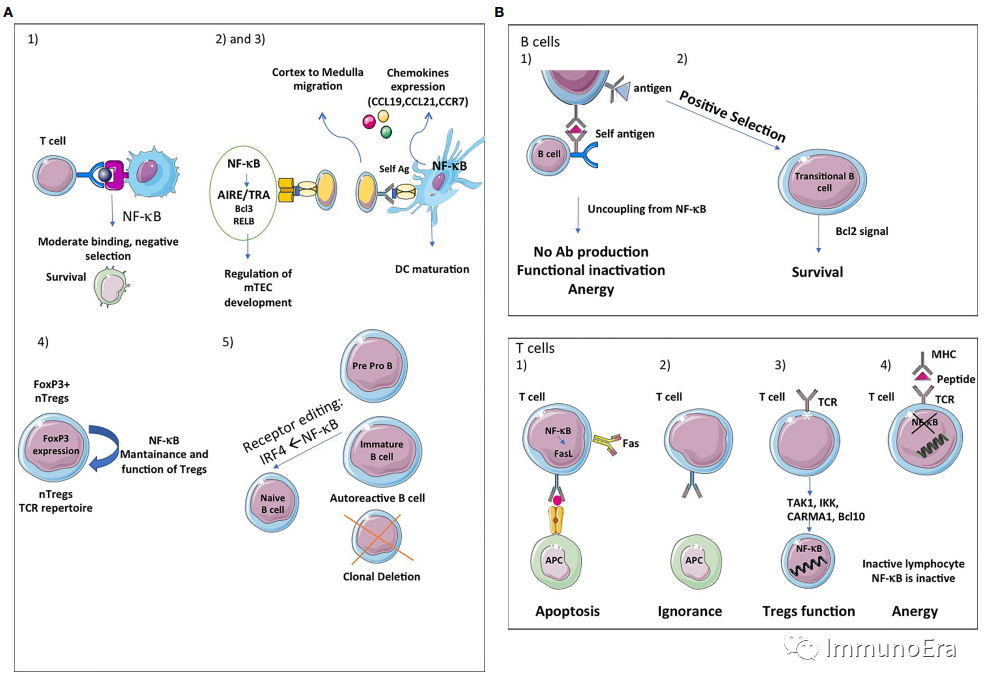
中枢耐受性
胸腺基质对T细胞受体库的生长、分化、阳性和阴性选择至关重要。
胸腺间质室由上皮细胞、成纤维细胞、内皮细胞、巨噬细胞和树突状细胞组成,每个细胞在T细胞的发育中都有不同的作用。
考虑到mTECs在呈递组织限制性抗原(TRAs)中的关键作用,阳性选择后的单阳性(SP)胸腺细胞必须迁移到髓质中进行阴性选择并进一步成熟。胸腺髓质确实是自身反应性胸腺细胞的阴性选择和Treg的阳性选择的主要部位,这是两个重要的中枢耐受机制。
首先,NF-kB激活的经典和替代途径有助于未成熟细胞在负选择过程中的存活。
第二,替代的NF-kB通路调控AIRE/TRAs的表达,并参与mTEC的发育、稳态和功能。Bcl3和RelB也在DNA水平上调控mTEC的发育。去泛素酶CylD与mTEC的分化有关。
第三,NF-kB还调节趋化因子(CCL19、CCL21、CCR7)的表达,这些趋化因子趋化DP胸腺细胞从皮质迁移向髓质以及次级淋巴细胞器官和组织。
第四,NF-kB通路也被证明会影响胸腺或天然Treg(nTreg)细胞的发育和功能。这些细胞识别自身抗原,并在维持免疫自我耐受中发挥重要作用。叉头Box P3(FOXP3)是这些细胞分化的主要转录因子。NF-kB对于nTreg的维持和功能以及FOXP3的表达具有重要意义。
第五,在B细胞中,NF-kB参与自身反应性B淋巴细胞的克隆缺失和受体编辑,这是一种正在进行的基因重排的保护机制,产生一种具有无害的特异性的新受体,防止细胞凋亡死亡。如果BCR识别自身抗原,则其在NF-kB的靶基因IRF4的控制下被下调。
外周耐受性
外周耐受目的是确保逃离胸腺选择的T细胞和B细胞不能产生自身免疫。
NF-kB信号通路对于次级和三级淋巴器官的发育和维持至关重要。
-
无能,其特征是BCR信号脱敏,与NF-kB通路解耦,导致抗原呈递和抗体产生失败。














