微针辅助经皮给药系统的研究进展
Development of Micro-needle Assisted Transdermal Drug Delivery System
沈 晨,夏 旭,高文彦,曾珊珊,叶金翠*
(浙江省医学科学院,浙江杭州 310000)
摘要:
微针辅助药物经皮给药系统(micro-needle assisted transdermal drug delivery system,MN-assisted TDDS)是指利用微
针对皮肤进行预处理,微针穿透角质层形成微孔通道,然后给予经皮给药制剂使药物通过微孔通道渗透进入皮肤的给药方式。与单独使用透皮制剂相比,微针辅助经皮给药可以明显提高药物经皮吸收的速率,并且能促进蛋白质、多肽等大
分子物质以及水溶性药物的透皮吸收,因此在经皮给药系统研究领域有良好应用前景。本文从药物经皮促进机制、研究
现状以及存在的瓶颈等方面对微针辅助经皮给药系统进行了综述,并展望了微针辅助经皮给药的发展前景。
关键词:
微针;经皮给药系统;透皮吸收;微孔通道;综述
经皮给药系统是制剂研究的热点之一,经皮给
药方式避免了口服给药可能发生的肝脏首过效应及胃肠道灭活作用,增强了疗效;维持稳定的血药浓度以避免峰谷现象;延长作用时间,减少用药次数,提高了患者用药顺应性;患者可以自主用药,在产生不良反应时可及时终止给药,增加了用药的安全性[1]。一般可经皮给药的药物需同时满足以下条件:有效剂量小、药理作用强;相对分子质量在500 以下;氢键供给体少于5 个,氢键接受体少于10 个且油水分配系数适中,否则难透过皮肤[2]。这些条件限制了经皮给药系统的应用范围,将多数药物拒之门外,特别是大分子药物如多肽类、蛋白质类。
角质层是药物经皮渗透的最大屏障。过去30
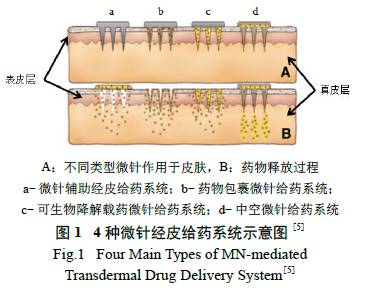
年间,基于不同的促渗透机制发展了物理和化学等不同的促透方法。物理促透方法包括电穿孔、超声波、离子导入和微针等[ 3],其中微针经皮给药系统最具发展前景,近年文献报道也呈现显著增加趋势[4]。目前研究较深入的微针经皮给药系统主要有4 种类型[5],如图1 所示。其中微针辅助经皮给药系统(micro-needle assisted transdermal drug delivery system,MN-assisted TDDS),又称之为“poke and patch drug delivery system”,系指采用微针对皮肤进行预处理,微针穿透角质层形成微孔通道,然后使用经皮给药制剂,借助微针形成的微孔道促进药物经皮吸收的给药方式。其具有如下优势:微针的制备工艺简单,透皮吸收速率稳定[6];患者自主给药,发生不适时患者可以自行停止用药。因此,MNassisted TDDS 更易开发成为新的产品,具有较好的发展前景。
1 微针促进药物透皮吸收的机制
皮肤是人体面积最大的保护器官,由表皮、真
皮、皮下组织以及皮肤附属器( 包括汗腺、皮脂腺、指甲、趾甲) 组成[7]。表皮没有血管与神经分布,表皮的上层即角质层,主要由角蛋白和神经酰胺组成。角质层的存在能保护皮下组织免受外界的化学性、物理性刺激,同时也避免了皮下组织的水分流失,也因此角质层是药物经皮转运的主要屏障。
2 微针辅助经皮给药系统的研究现状
自20 世纪90 年代第一篇以钙黄绿素为模型药
物的微针经皮给药系统研究发表以来[12],微针经皮给药系统已取得长足发展。有统计显示,过去5年关于经皮给药技术的文献资料中有近30%的研究与微针技术有关[13]。而微针技术作为一种新型药物促透技术最早以MN-assisted TDDS 方式出现[12]。随着微制造领域的发展,微针的制备材料及制备工艺都有了突破性的进展。同时,MN-assisted TDDS的研究也越来越深入。
2.1 微针的制备
微针的制备材料最初采用硅材料[ 14],如今已
拓展至金属( 不锈钢)、聚合物( 葡聚糖、微晶纤维素、交联聚维酮)、陶瓷等[15—17]。制备工艺也日新月异,包括化学蚀刻(chemical etching) 技术[18]、表面/ 体积微加工技术(surface/bulk micromachining)、激光镭射技术[19]、模具注塑技术等。微针的设计( 不同尺寸以及形状) 以及微针的类型( 固体微针、中空微针、可溶性微针) 也变得多样化。
2.1.1 化学蚀刻技术制备硅材料微针
化学蚀刻技术制备硅材料微针需要进行光刻和
蚀刻2 个步骤。①光刻:将表面光滑的硅片置700 ~1 150 ℃且具有一定湿度的氧气中进行氧化,直至其表面形成一层厚度均匀的氧化硅薄膜,薄膜的厚度与需要制备的微针的长度一致,然后在氧化层表面均匀涂布一层光敏材料,利用紫外光透过光栅照射,硅片表面的光敏材料与紫外光接触的部分会被降解掉,未受到紫外光照射的部分依然附着在氧化硅表面。用溶剂洗去降解产物,暴露出氧化层后残留的光敏材料呈点状,即完成光刻过程。②蚀刻:利用化学反应或者物理撞击将暴露出来的氧化硅移除,剩余部分就形成了针状的结构,最后将针状结构尖端的光敏材料经紫外线照射降解再经溶剂洗去就完成了硅材料微针的制备。用化学蚀刻技术制备硅材料微针时,微针的长度通过氧化程度即氧化层的厚度来进行调节,微针的密度可以根据光栅来调节,该制备工艺复杂,所形成的微针形态为柱状,对皮肤的穿刺效果较差。
2.1.2 表面/ 体积微加工技术
表面/ 体积微加工技术是基于微机电系统
(micro-electromechanical systems,MEMS) 发展而来的一种精细加工技术,其思路是通过大机器制造出小机器再利用小机器制造微机器。利用这种方法制备微针,其加工精度为微米或亚微米级别,例如:杭州机床厂产的三轴数控超精密坐标磨床UGK7120X5,轴定位精密度为0.2 μm,进给量为0.1 μm,能够满足微针制备所需要的精度要求并且由计算机程序进行控制,能保证微针制备的重复性[20]。用表面/ 体积微加工技术制备微针优点是:微针制备材料范围广,比如多晶硅、不锈钢、贵金属、陶瓷、玻璃等,微针的形态以及微针长度可以通过计算机程序预设;但缺点也非常明显,制备步骤繁琐,耗时长,成本高,普通实验室难以实现。
2.1.3 金属微针的激光镭射制备方法
在不锈钢板上用激光镭射的方法切割固定的图
案,然后将切割部分直立就形成了一个简易的微针阵列,如图2 所示。Banks 等运用该法制备了微针阵列并用其预处理豚鼠皮肤,贴上纳曲酮贴片[ 21]。试验结果显示,微针在豚鼠的在体皮肤上形成的微孔通道能维持48 h,该MN-assisted TDDS 给药后比单独使用经皮给药系统能更早达到有效血药浓度,起效更快。用这种方法制备微针的操作简单,能够控制微针长度、形状以及微针阵列密度,可满足试验中对微针参数的不同要求。所用材料不需特殊处理,经消毒后可重复使用。相较于化学蚀刻技术,金属微针的激光镭射制备方法降低了制备工艺以及材料上的成本,容易推广与普及,有利于工业化生产。但该法依然存在一些不可忽略的缺点,如:微孔通道呈扁平状,容易闭合,影响药物透过量;微针阵列密度小于用其他方式制备的微针。

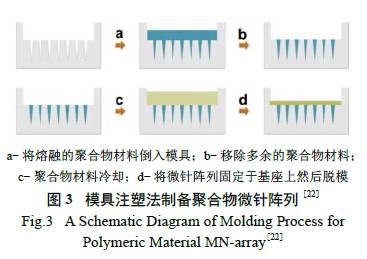
2.1.4 聚合物微针的模具注塑制备方法
使用该种微针制备方法时通常先用单晶硅、不
锈钢或者陶瓷等材料制备微针模具,然后将聚合物材料加热熔融并灌注到模具中,再冷却脱模得到所需要的微针阵列,如图3 所示[22]。微针的形状、尺寸以及阵列密度取决于模具,一种模具只能制备一种微针,且模具的制备工艺复杂。此外,模具在微针制备过程中容易有材料残留,导致微针的形状不均一,使用过后清洗困难,因此该方法适合在实验室小规模使用,工业化生产有一定难度。但该法制备微针也有其优势。例如,可控制微针形状( 如圆锥形、棱锥形),可在表皮形成形状规则的孔道,对维持微孔通道的开启状态有一定作用[ 23];此外,还能够选择不同的聚合物材料,从而筛选出与生物体相适应的材料。
2.2 微针辅助经皮给药系统的应用研究
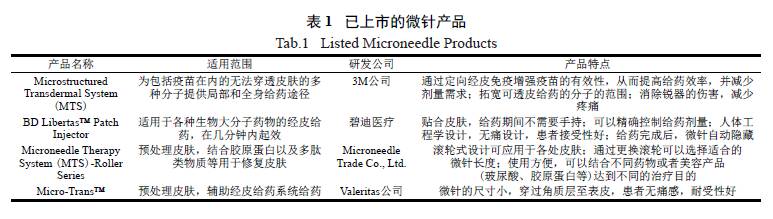
随着微针制备技术的发展,目前已有多种不
同应用的微针产品上市,详见表1。这些产品为MN-assisted TDDS 提供了技术支持,促进了Nassisted TDDS 的发展。自2000 年以来,有较多文献报道了MN-assisted TDDS 促进小分子化合物透皮吸收的研究,包括了离体皮肤试验、动物试验以及临床研究。此外,还有研究者进行了MN-assisted TDDS 对大分子化合物、生物大分子药物的经皮促透作用以及影响MN-assisted TDDS 经皮促透效果因素的研究,扩大了经皮给药系统的应用范围,为其他药物应用于这种给药系统提供了参考。
2.2.1 小分子化合物
利多卡因作为局部麻醉药,经常用于术前局麻,
但通常需要注射给药起效。这种麻醉方式被称为表面浸润麻醉[24]。表面浸润麻醉要求注射时药物溶液与组织中的神经末梢充分接触,又不能注射到血管中以免血管收缩导致局部组织坏死,通常会给患者带来不适感。Nayak 等用微针预处理皮肤,然后使用盐酸利多卡因贴片给药达到了与注射给药同样的局部麻醉效果[25]。同时得出了麻醉效果与微针的长度、密度以及微针处理皮肤的力度、时间都存在正相关性的结论。美国Oklahoma 大学进行了利多卡因的微针辅助经皮给药系统的临床试验,采用的是阵列面积为1 cm2 的不锈钢微针阵列[26]。目前该研究进行到临床Ⅲ期。
2.2.2 大分子化合物
多西他赛属于紫杉烷类抗肿瘤药,其作用机制
是加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,从而破坏肿瘤细胞的有丝分裂。多西他赛主要治疗晚期乳腺癌、卵巢癌、非小细胞肺癌,对头颈部癌、小细胞肺癌,以及胃癌、胰腺癌、黑素瘤癌等也有一定疗效。Qiu等利用微针阵列( 包含484 根长度为150 μm 的八角锥形微针) 预处理大鼠和猪的离体皮肤,然后进行皮肤渗透试验,结果显示微针预处理增加了多西他赛的稳态渗透速率以及累积渗透量[32]。
2.2.3 生物大分子
McAllister 等制备了不同材料、不同尺寸形状
的固体微针,以胰岛素为模型药物,比较了微针辅助经皮给药方法和经皮给药方法对下调糖尿病大鼠血糖水平的效果[34]。结果显示,皮肤经微针预处理后通透性增加,能促进胰岛素的透皮吸收,起到到降低血糖水平的作用;而单独经皮给药未见明显血糖水平下降。但微针预处理的试验组在48 h 后继续经皮给予胰岛素,糖尿病大鼠的血糖水平未见下降。McAllister 等对微针辅助胰岛素经皮给药不能持续调节血糖水平的原因进行了探究,采用显微镜观察经微针预处理48 h 后和微针新处理的大鼠皮肤,比较两组皮肤上微针所致微孔通道的差异。结果显示,微针处理48 h 后,微孔通道基本闭合,新处理的皮肤上则微孔通道明显。上述结果提示,微针预处理皮肤可促进胰岛素的透皮吸收,但微孔通道在48 h 内闭合。
2.3 微针辅助经皮给药系统发展的瓶颈及解决方案
MN-assisted TDDS 是通过微针预处理皮肤,在
表皮层制造微孔通道从而促进药物透皮吸收。受种族、地区和生活习惯等因素影响,表皮层的厚度存在个体差异,用同样规格长度的微针处理不同厚度的皮肤,可因为透皮促进作用的不同导致药效的差异。针对该情况可借鉴注射器的型号分类,制备不同长度的微针并统一规定型号。测试给药部位的表皮层厚度,再选择相应型号的微针。表皮层厚度可通过高频超声仪或拉曼光谱( 漫反射光谱) 进行测定[37—38],这些方法均非侵入性的,能快速高精度地测量,其中拉曼光谱的检测精度能达到1 μm。
另外,由于人体皮肤具有弹性,在使用微针预处理
皮肤时,如果微针受力大小不同会导致形成的微孔通道深度不同,从而造成药效差异。Trautman 通过设计一种预设自动触发装置来解决这一问题[39]。该装置与表1 中介绍的微针产品相似,不同之处在于微针与手指按压部位之间有一个弹簧,可以在使用前设定微针与按压部位的距离使弹簧处于蓄能状态,然后将微针贴合皮肤,触动装置,弹簧舒展推动微针刺穿角质层。用弹簧推动微针代替手动按压能够保证每次使用时形成的微孔通道深度一致,从而消除因微针刺入深度不同而带来的药效的差异。
3 展望
MN-assisted TDDS 拓展了经皮给药系统的适用
药物范围,特别是使多肽、蛋白等生物药物的经皮给药成为可能,具有较好的应用前景。随着微针制备技术的发展,MN-assisted TDDS 应用研究的不断深入与完善,预期在不久的将来会有越来越多微针相关产品被应用于疾病的治疗、诊断和预防。但是如何将MN-assisted TDDS 更广泛、更安全的应用于临床,让患者真正受益,还需要针对微针技术的应用瓶颈作更深入的研究。
基金项目:浙江省科技厅项目(2014F10034、2016F50016、
2017C33147)、浙江省卫生高层次创新人才培养工程项目
作者简介:沈 晨(1991—),男,硕士研究生,专业方向:经皮给
药制剂。
E-mail:[email protected]
通信联系人:叶金翠(1974—),女,博士,研究员,主要从事经皮
给药制剂研究。
Tel:0571-88215573
E-mail:[email protected]