BioArt按
:
最近一段时间,有关“相变”或“相分离”
(
Phase separation
)的文章不断地出现在CNS杂志上
(
4月份Cell同事在线的4篇关于FUS的论文可以参考,详见BioArt过去的报道:
李丕龙教授特评丨生物大分子的“相变”——简谈近期系列“相变”研究成果
)
,一周前
Cell
还发表了有关于mTOR调控相分离的文章,引起了同行的广泛关注(
BioArt近期将会推出解读文章
)。围绕相分离与转录调控,过去也有一些研究,最近周强研究组的工作揭示了相分离对基因转录调控的分子机制(
Nature丨厦大/UCB周强组揭示相分离对基因转录调控的分子机制——刚柔并济的分子调节及药物开发新理论
)。此外,
2017年MIT的Phillip Sharp和Richard Young等在
Cell
上发表观点性文章,
提出了一个以相分离理论解释超级增强子参与基因调控的模型,但没有直接的实验证据。然而近日,Richard Young组就在
Science
上发表研究长文为超级增强子通过相分离调控基因表达的模型提供了实验证据。为了让读者更好的了解Richard Young组的这项重要工作,BioArt特别邀请到了北京大学生命科学学院
季雄
(
第14批“青年千人”,Richard Young的博后
)研究组对该工作进行了权威解读,以飨读者!
撰文丨
周蓉、段文嘉、季雄(北京大学)
责编丨迦 溆

相
是自然界中一种常见的物理现象
(比如水有气相、液相和固相)
,相在物理领域已经研究了上百年。早在1899年细胞生物学奠基人E.B Wilson 就提出“
细胞内的物质可能是液体,或者是液体的混合物,分别代表了不同的化学活性
”
【1】
,但是当时我们对于控制细胞内生命活动的分子都知之甚少,所以这一观点一直被忽视。经过数十年的遗传学、生物化学、分子生物学和基因组学等相关研究,我们已经鉴定了足够多的调控分子。以基因调控为例,我们已经鉴定了一百多万个DNA调控元件,数十万个RNA调控分子和两千多个蛋白因子控制人体细胞中的基因表达,但是我们不知道这些分子如何在一起完成复杂的基因调控过程。由此相分离模型
(phase separation)
应运而生
【2-5】
,相关研究在不同领域近期出现了“井喷”现象。
超级增强子
(super-enhancer)
是由连续排列的增强子串联形成的增强子簇,决定细胞特性和功能的大多数关键基因附近通常伴随着出现超级增强子
【6, 7】
,超级增强子上有高密度的转录相关蛋白和RNA,但是其决定细胞命运具体的分子机理一直不清楚。2017年麻省理工学院的Phillip Sharp与Richard Young就曾在
Cell
杂志上发表观点性文章,提出了一个以相分离理论解释超级增强子参与基因调控的模型
【8】
,但没有直接的实验证据。2018年6月21日
Richard Young
课题组在
Science
发表了题为
Coactivator condensation at super-enhancers links phase separation and gene control
的文章
【9】
,该文报道了转录共激活因子BRD4和MED1可以在超级增强子处发生相分离形成液滴,将转录机器聚集在超级增强子附近,实现转录过程的区室化反应,其中内在无序区域
(intrinsically disordered regions,IDRs)
在相分离过程中发挥关键作用,
这项研究为超级增强子通过相分离调控基因表达的模型提供了实验证据,也对细胞命运决定和疾病发生过程中关键基因的表达调控过程提供了全新的视角和概念
。
转录共激活因子BRD4与MED1是超级增强子的重要组分蛋白,该研究团队首先构建了稳定表达mEGFP-BRD4/mEGFP-MED1的mESC细胞系,免疫荧光和活细胞成像数据表明BRD4与MED1在细胞核内以亮斑的形式存在。通过ChIP-seq、DNA荧光原位杂交及新生RNA荧光原位杂交证据表明这些亮斑和超级增强子呈现共定位。
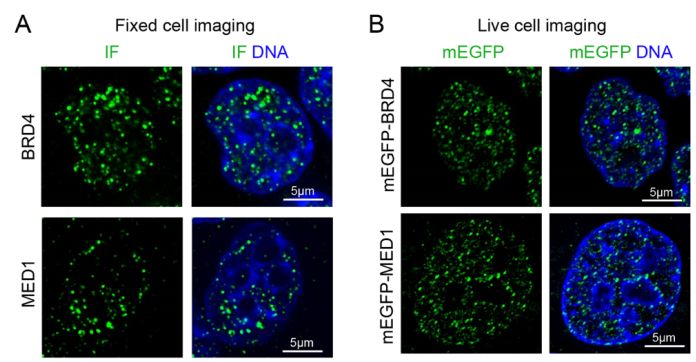
BRD4与MED1在细胞内形成聚集
接着该研究团队对BRD4与MED1形成的亮斑进行荧光漂白恢复实验,发现这些点状聚集体的恢复速度和之前报道的液滴状聚集体的行为相似。通过消耗细胞内的ATP发现细胞内BRD4与MED1形成的聚集体恢复速度降低;当用药物1,6-己二醇
(1,6-hexanediol)(该化合物可以通过破坏疏水相互作用破坏液滴状聚集体)
处理细胞后,细胞内BRD4与MED1形成的亮斑数量明显减少。这些证据表明BRD4与MED1形成的生物大分子聚集物具有液滴的性质。
随后该研究团队通过ChIP-seq实验,发现1,6-己二醇处理后的细胞,BRD4与MED1在增强子特别是超级增强子处的结合能力明显降低,被超级增强子调控的相关基因的转录水平也明显下降。以上的证据表明
转录共激活因子BRD4与MED1在细胞中以相分离形式在超级增强子处成簇分布调控基因表达。
该研究团队对BRD4与MED1的内在无序区域进行纯化,发现它们在体外可以发生自组装形成液滴。液滴的大小与蛋白浓度、缓冲体系的盐浓度及疏水性有关,并且液滴的形成过程是可逆的。在体内,该研究团队利用了蓝光报告系统OptoDroplet证明内在无序区域也能够发生相分离,在蓝光的刺激下,观察到细胞内亮斑的形成,并且这些亮斑之间有融合的现象。荧光漂白恢复实验证明这些亮斑具有类似液滴的性质。以上的证据表明,
内在无序区域参与了相分离过程,其中MED1的内在无序区域中的丝氨酸对其发生相分离是必要的。
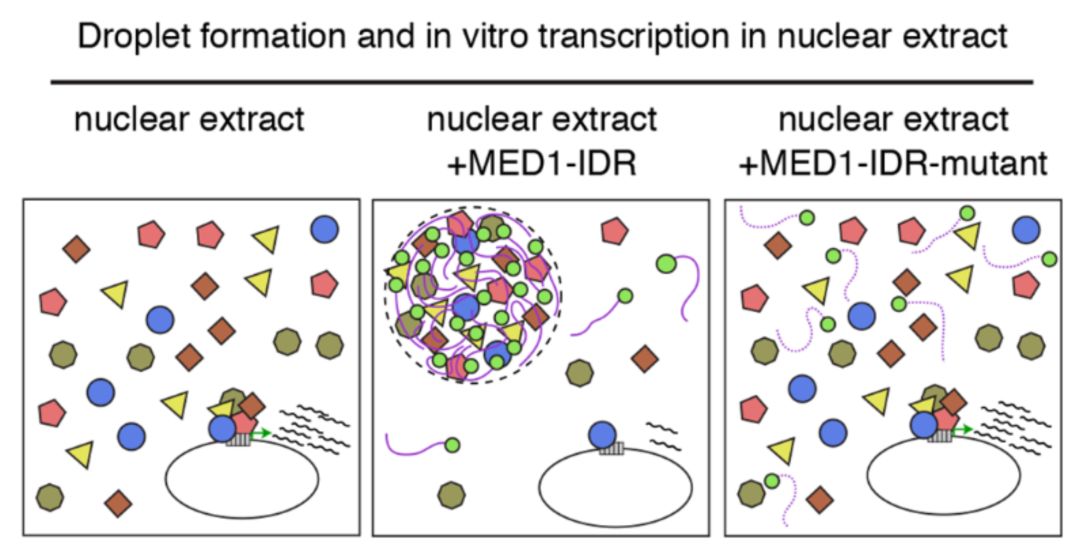
最后,为了研究BRD4与MED1相分离的生物学功能,该研究团队将纯化的
MED1内在无序结构域蛋白
(
MED1-IDR,intrinsically disordered regions
)加入到具有转录功能的细胞核提取物中,发现它可以形成液滴,
通过离心分离出液滴及体外的转录实验,结果显示
MED1液滴可以富集BRD4和RPB1蛋白
(
上图
)。
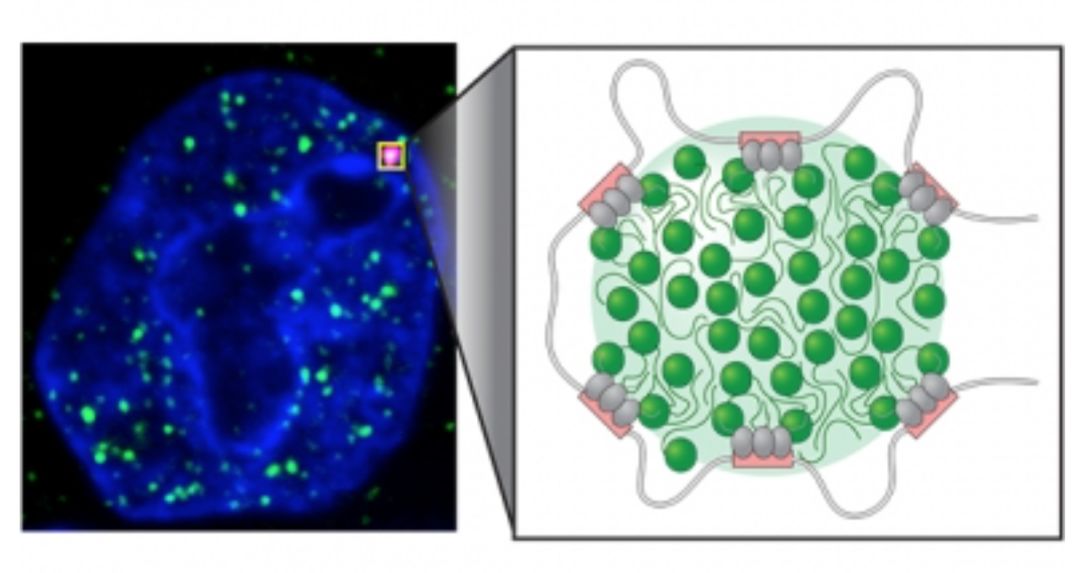 转录共激活因子形成液滴调控基因表达的新模型(引自:www.wi.mit.edu)
转录共激活因子形成液滴调控基因表达的新模型(引自:www.wi.mit.edu)
以上结果共同表明转录共激活因子BRD4和MED1能结合在超级增强子处,通过液液相分离从复杂的细胞核隔离出转录相关组分,调控关键基因表达
。该研究或许为我们理解细胞命运决定和疾病发生过程中的基因调控提供一个全新的视角。正如许多重要的研究引发的问题往往比解决的问题要多,未来我们期待:进一步阐明体内相分离相关组分和结构基础、破译相分离建立、维持和被破坏的密码,解析发育和疾病过程中相分离的动态调控等。
关于相分离的研究需要物理、化学和生物等学科的交叉融合,但无疑相分离理论在细胞物理化学的漫长历史研究中迎来了一个令人兴奋的新时代
。
















