▲点击上方的蓝色
“医谷”
关注我们
“置顶公众号”
第一时间获取最有价值行业趋势信息

医谷微信号:yigoonet
近日,国家食品药品监督管理总局医疗器械技术器审中心(CMDE)发布了《关于公示医疗器械技术审评专家咨询委员会第一批委员候选人名单的通知》(以下简称“通知”)。
《通知》指出,根据总局颁布的《医疗器械技术审评专家咨询委员会管理办法》(以下简称“办法”)第三条“国家食品药品监督管理总局医疗器械技术审评中心承担专家咨询委员会的组建、委员遴选与增补等工作”要求,CMDE按办法规定的遴选条件及程序,依据科学发展、技术进步以及审评工作的需要,开展了专家委员候选人遴选工作,拟设立17个专家咨询委员会,共征集专家委员候选人819人,包括25名院士。
其中,共有2个专家咨询委员会候选人名单人数过百,分别为外科用医疗器械专家咨询委员会(共111人)以及体外诊断试剂专家咨询委员会委员(共105人)。
具体名单如下:
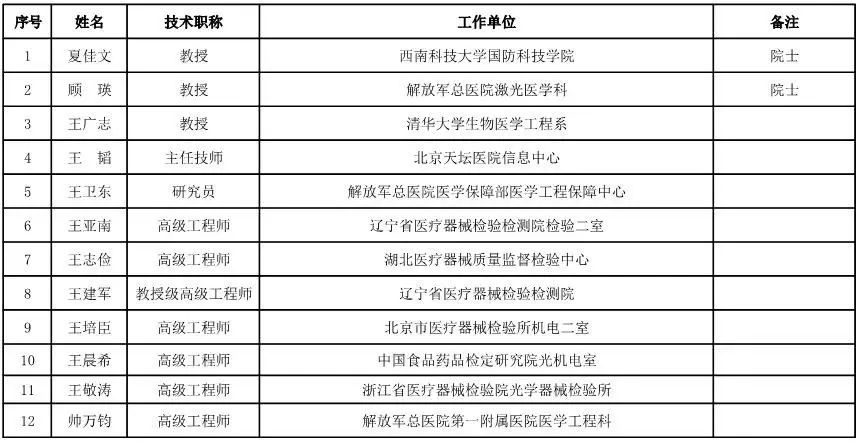
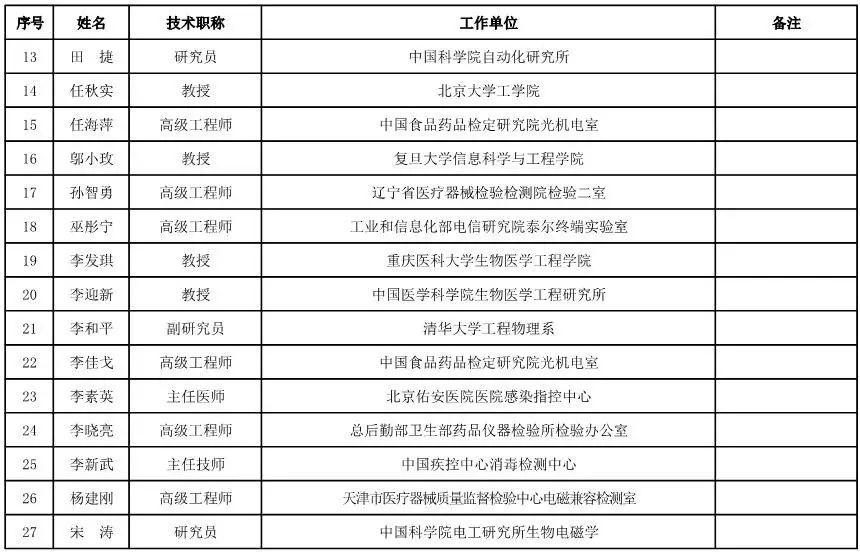
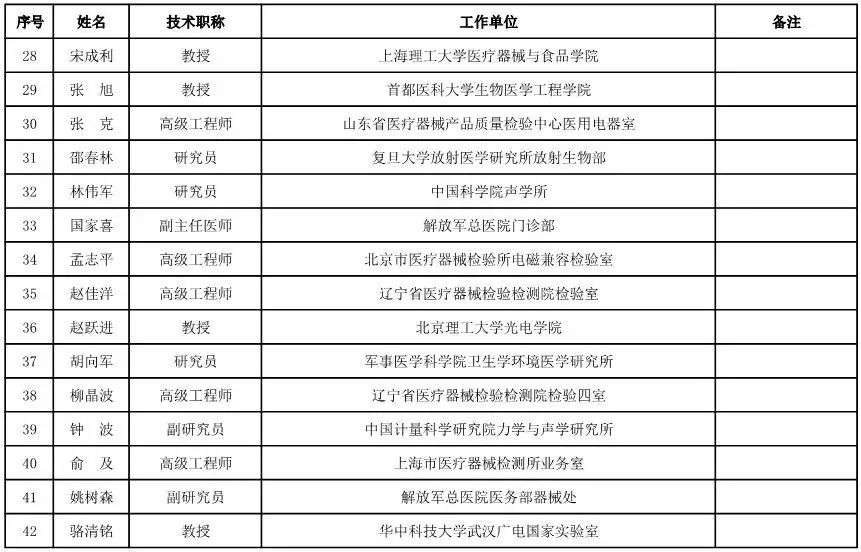
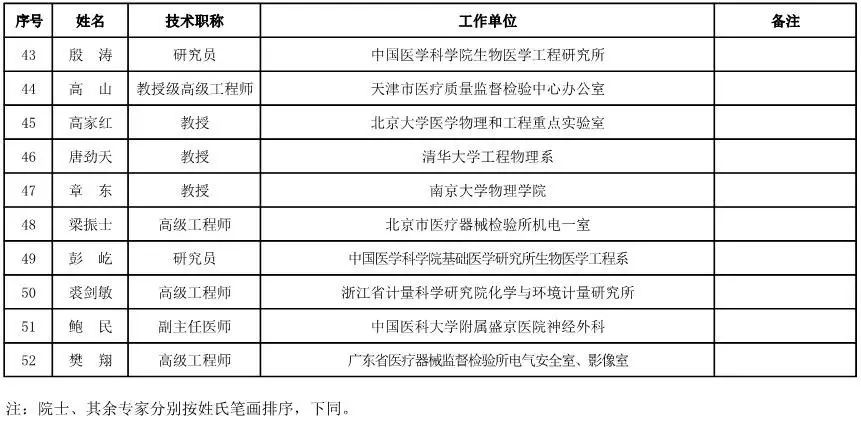
有源设备工程专家咨询委员会委员候选人名单
(共52人,包含2名院士)
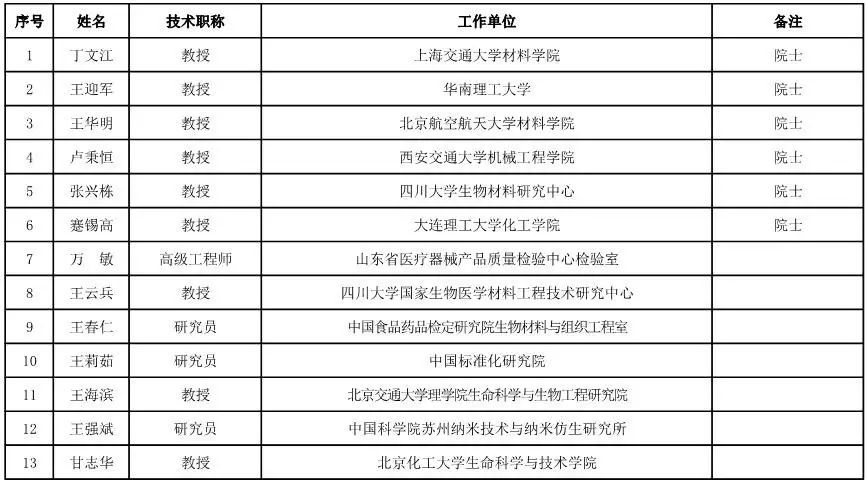
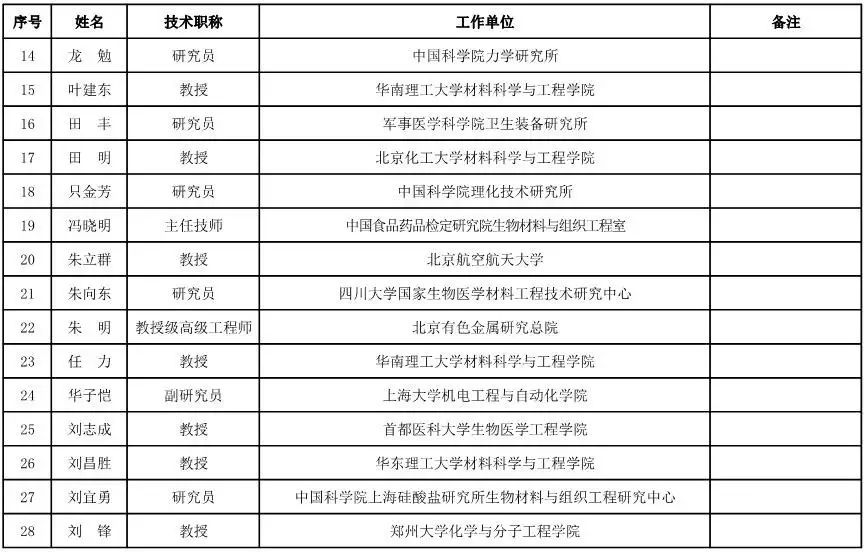
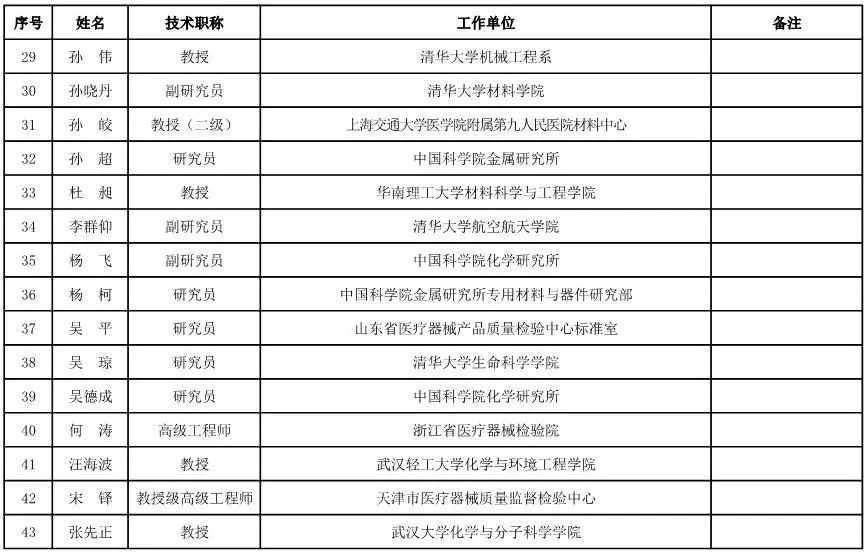
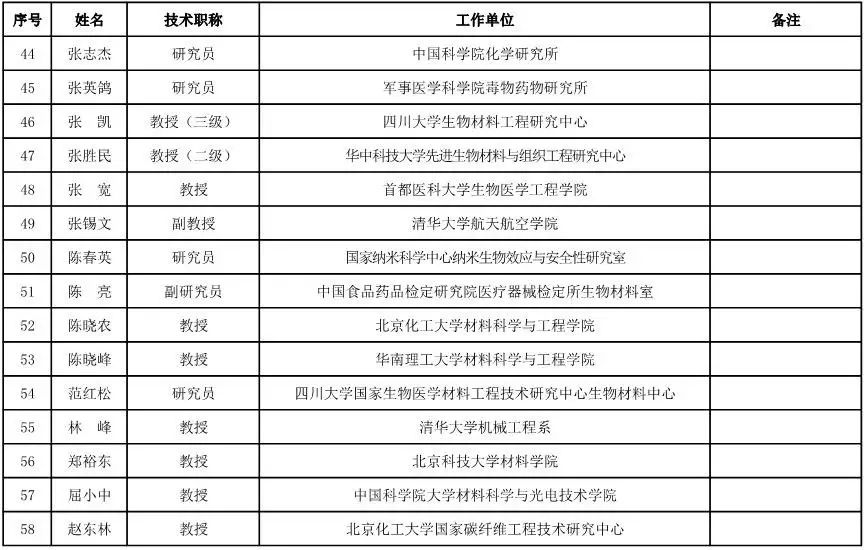
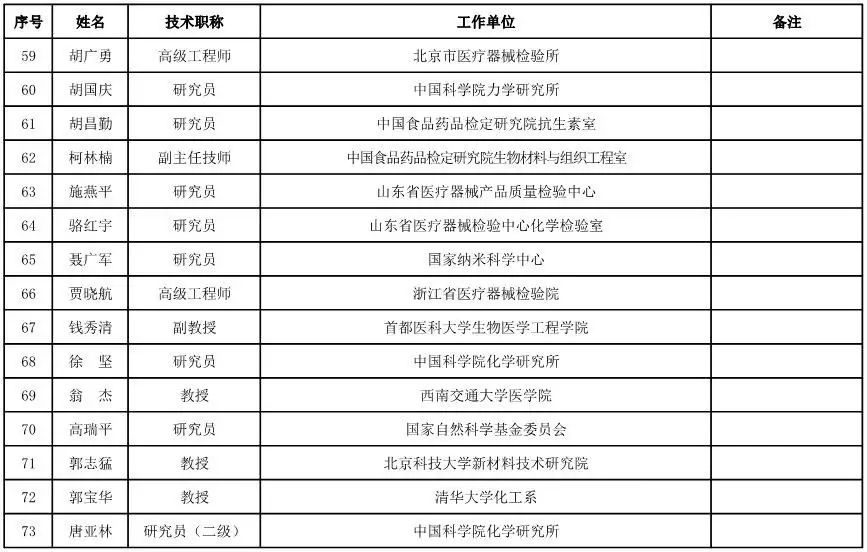
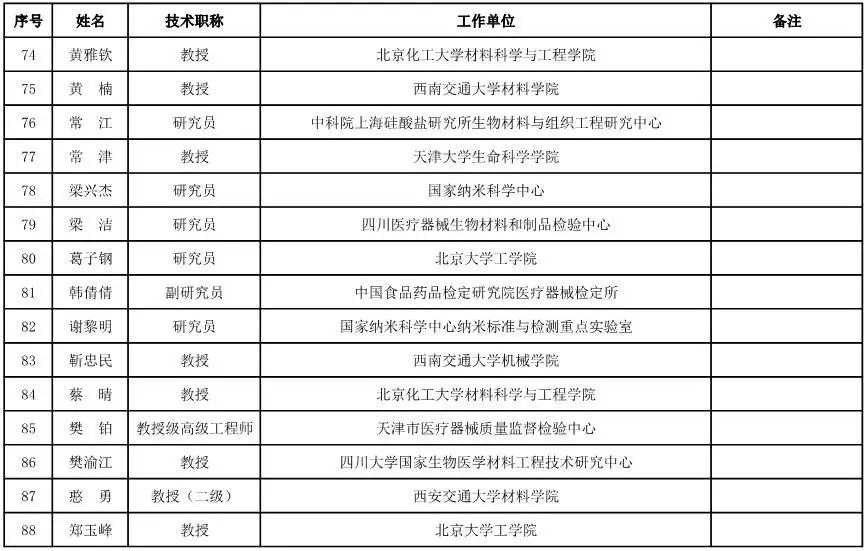
医用材料工程专家咨询委员会委员候选人名单
(共88人,包含6名院士)
医疗器械生物学评价专家咨询委员会委员候选人名单
(共27人,包含1名院士)

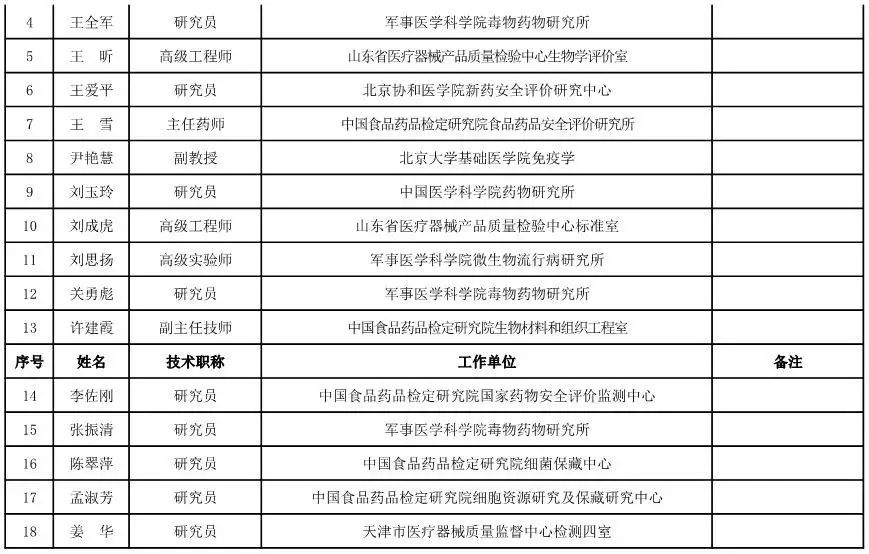

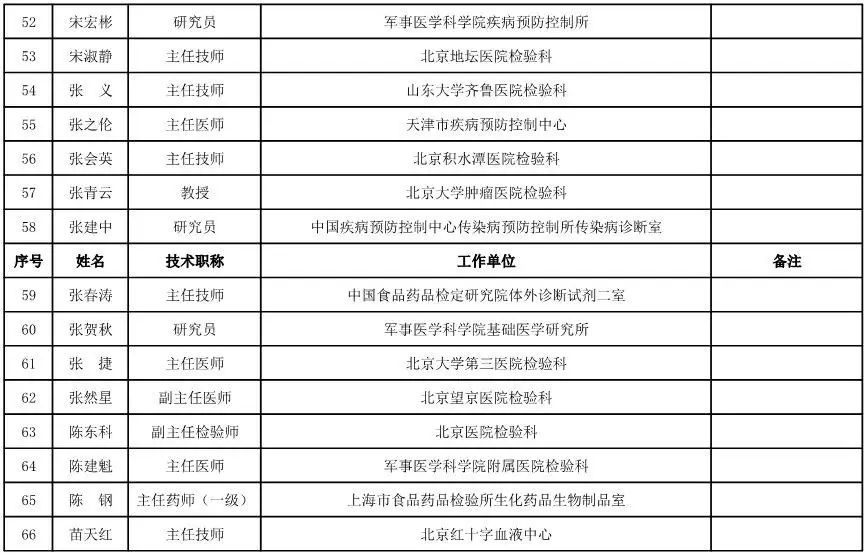
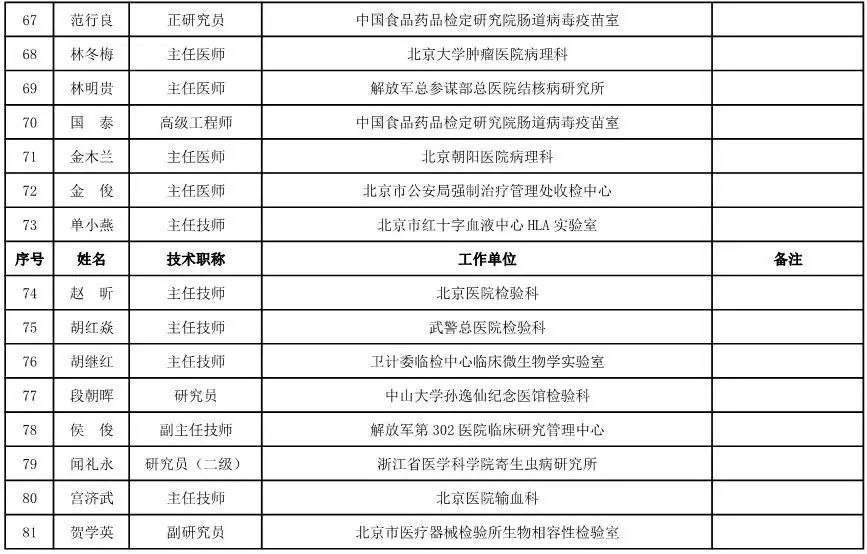
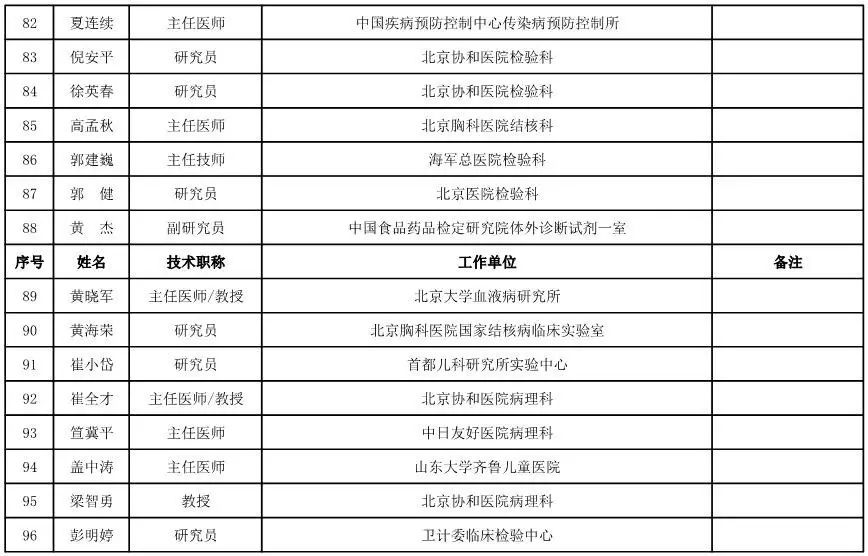
体外诊断试剂专家咨询委员会委员候选人名单
(共105人,包含3名院士)

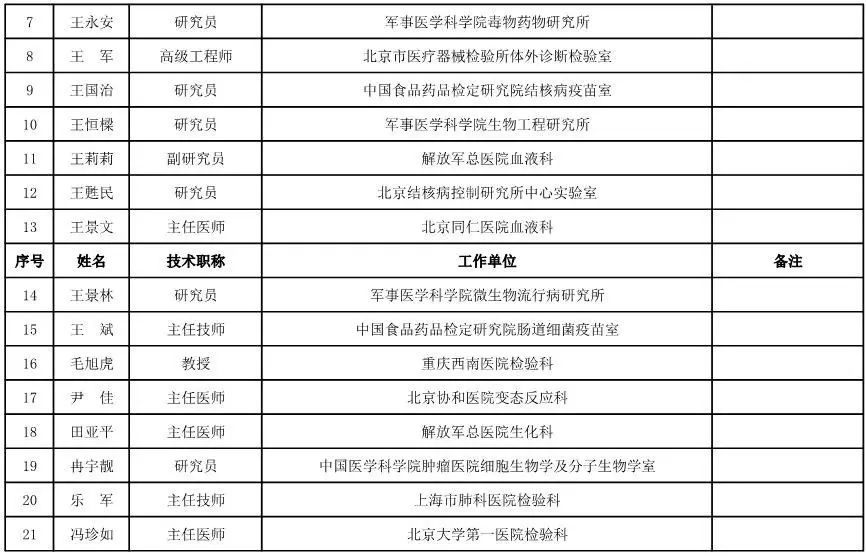
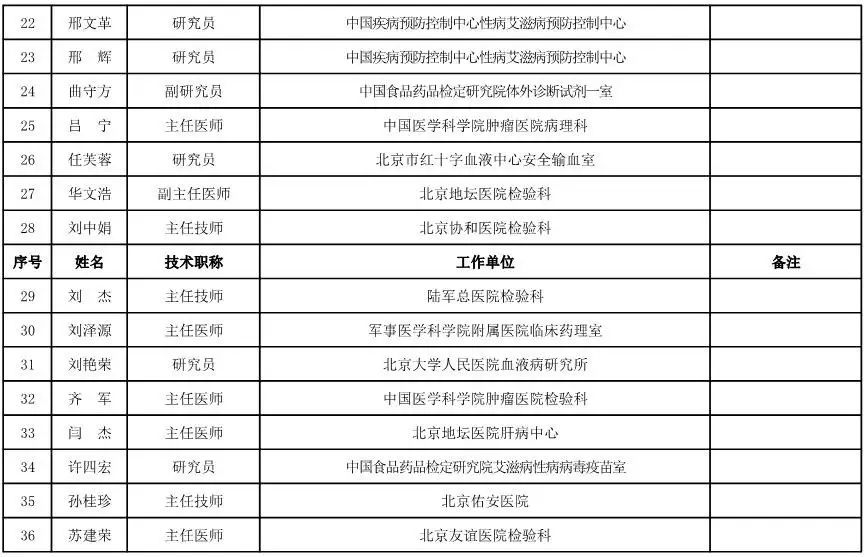
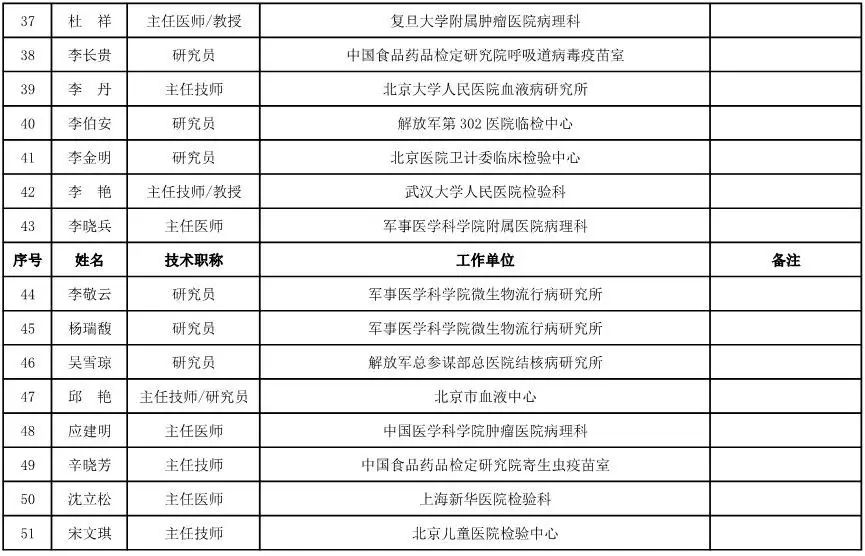

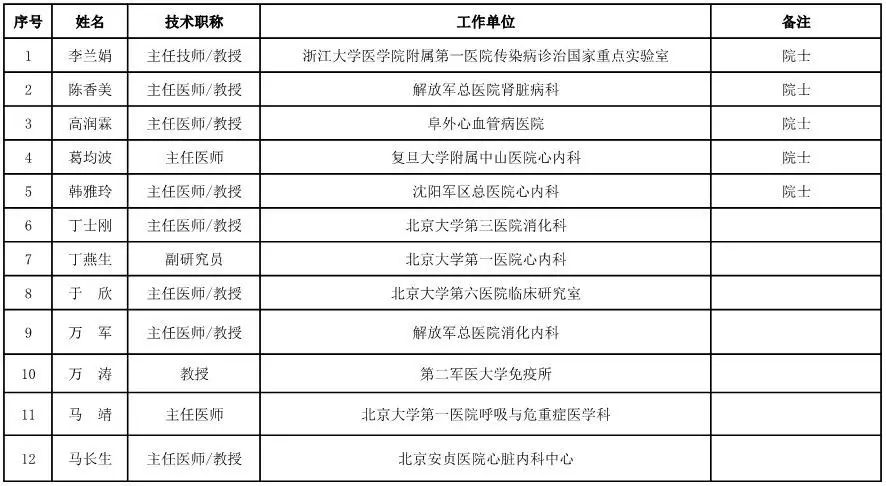
内科用医疗器械专家咨询委员会候选人名单
(共99人,包含5名院士)
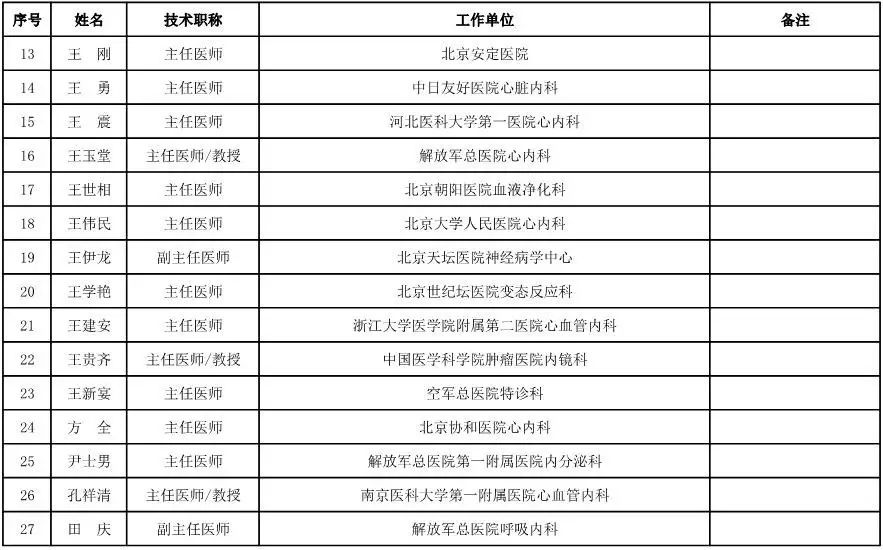
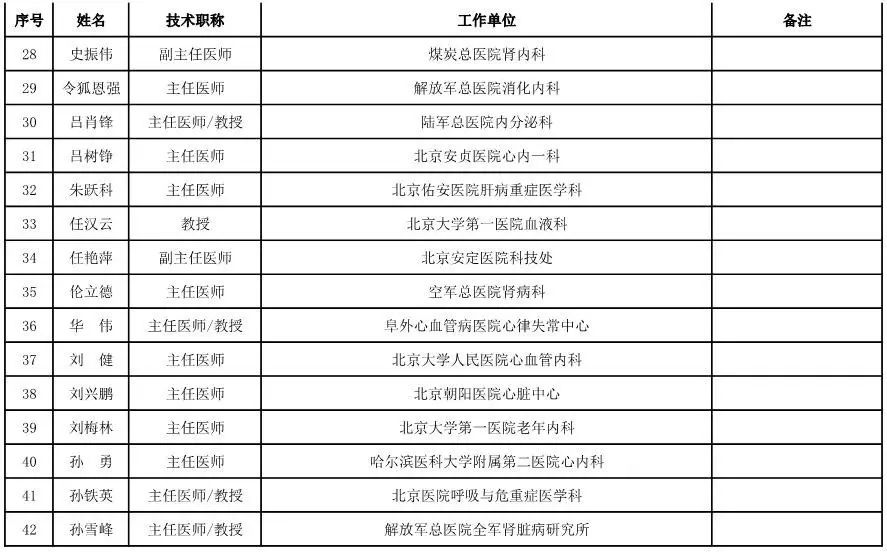
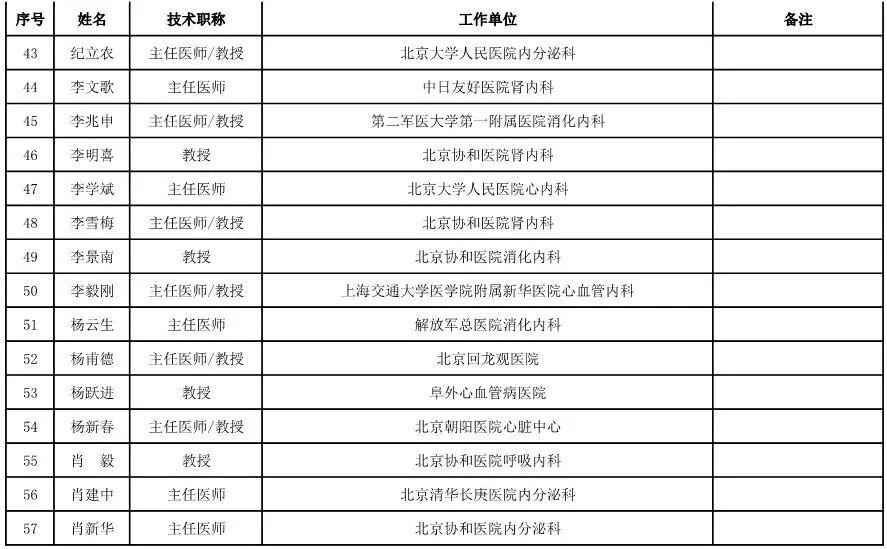
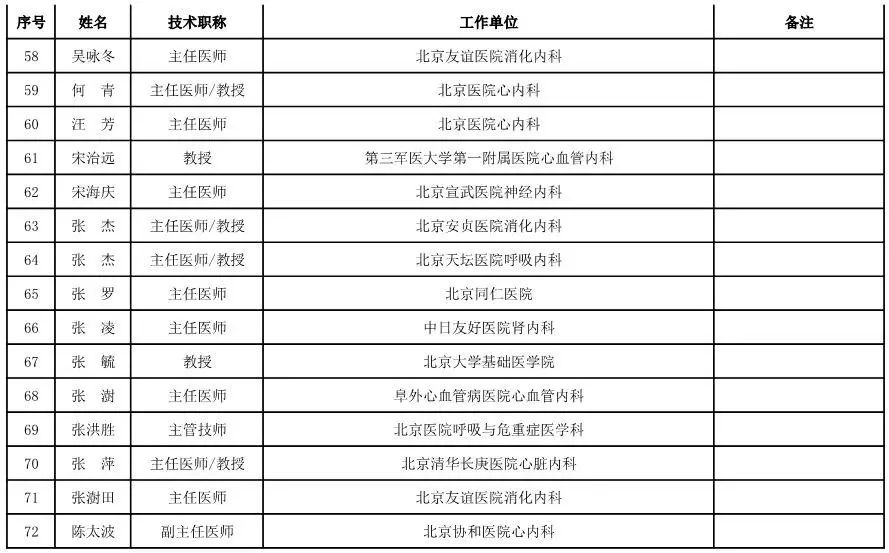
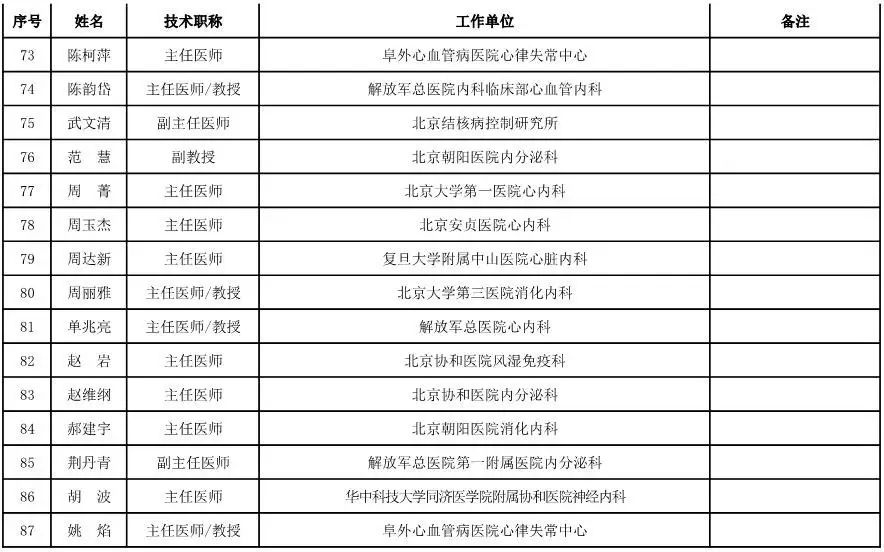
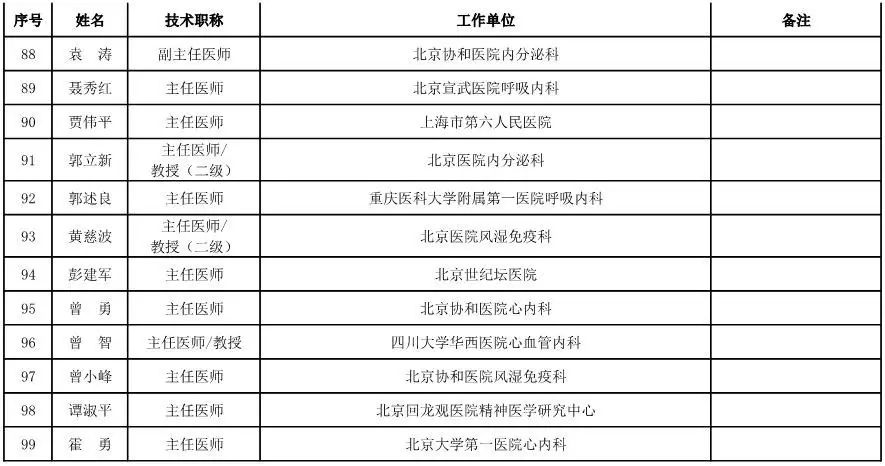
外科用医疗器械专家咨询委员会候选人名单
(共111人,包含4名院士)

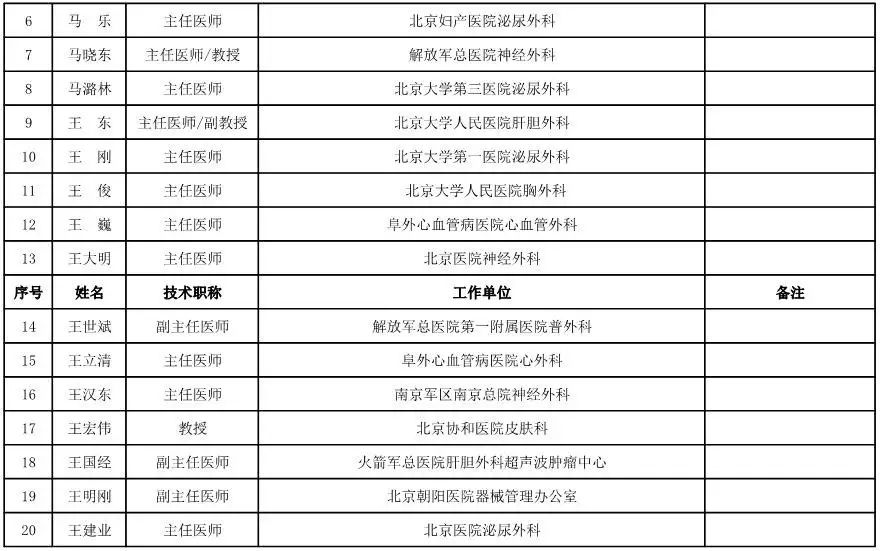
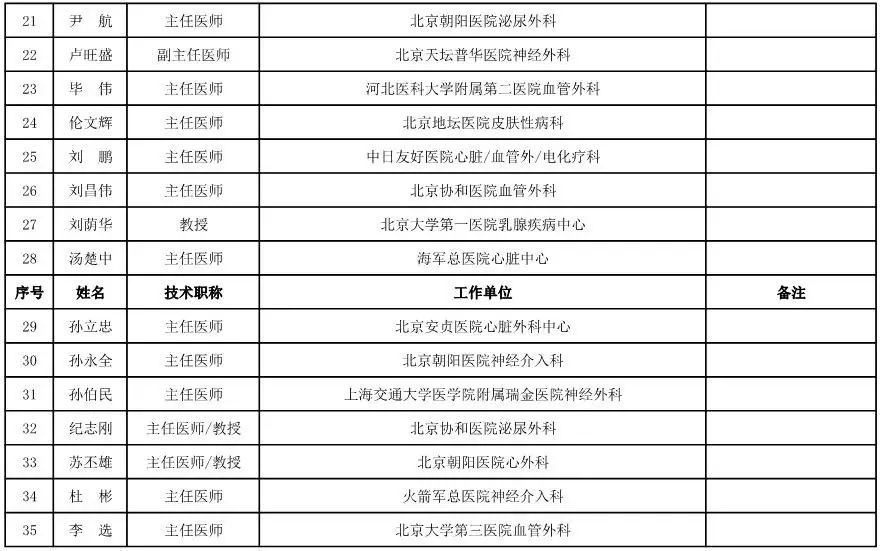
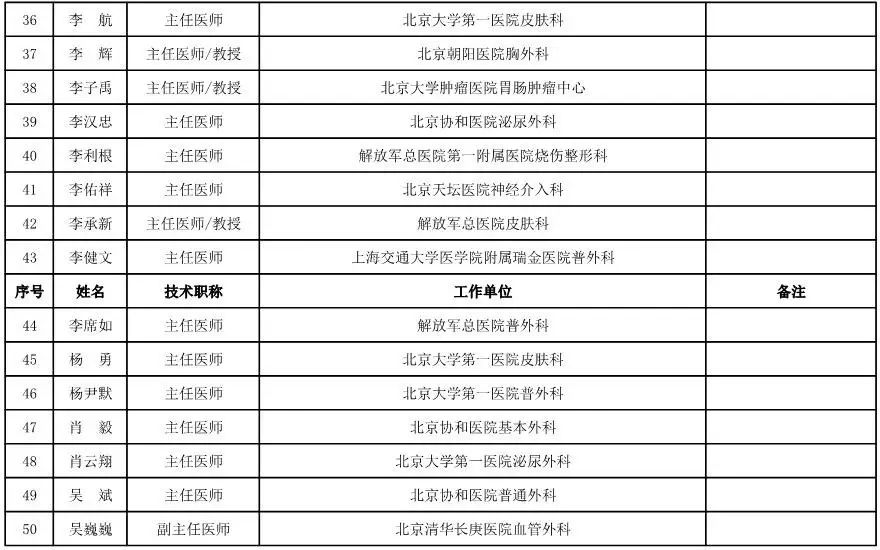
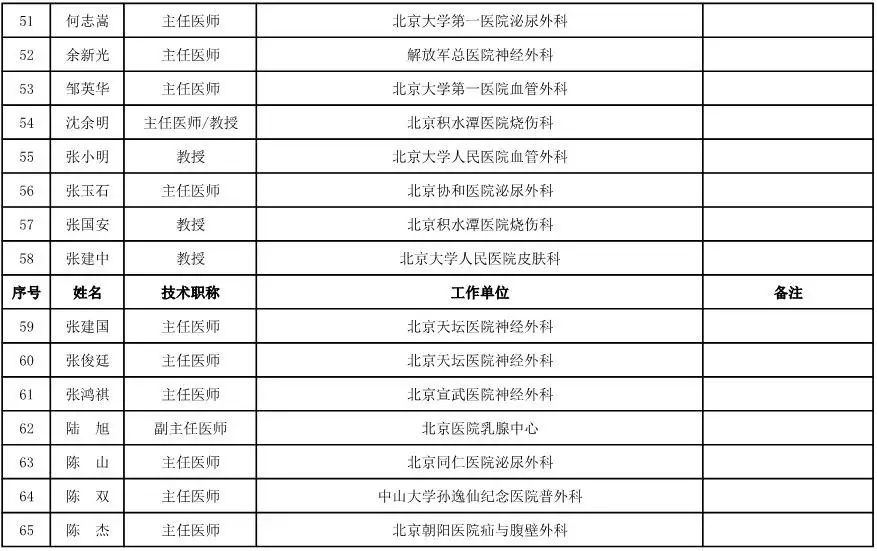
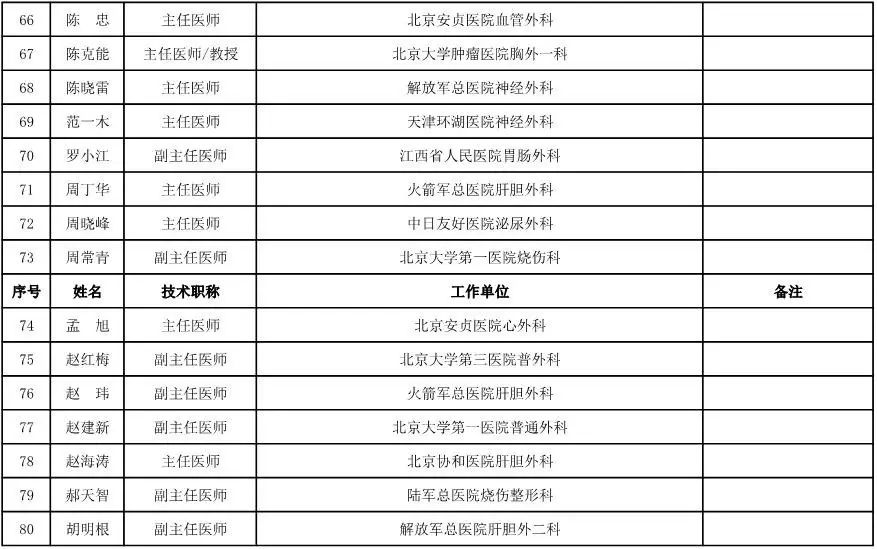
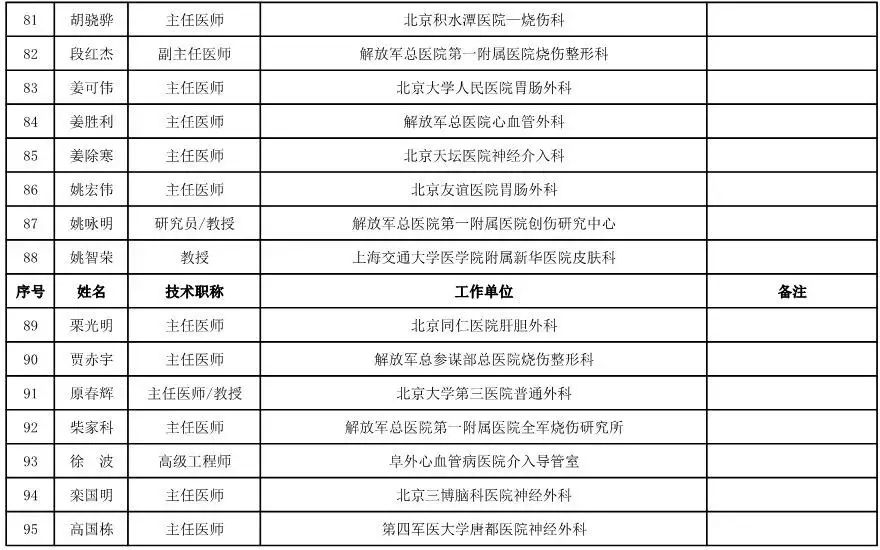
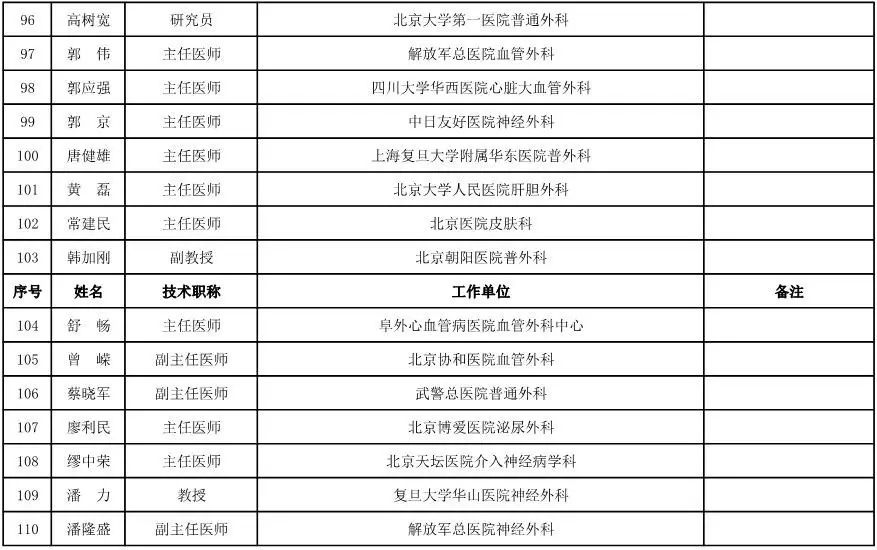

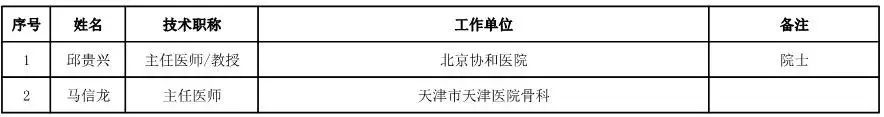
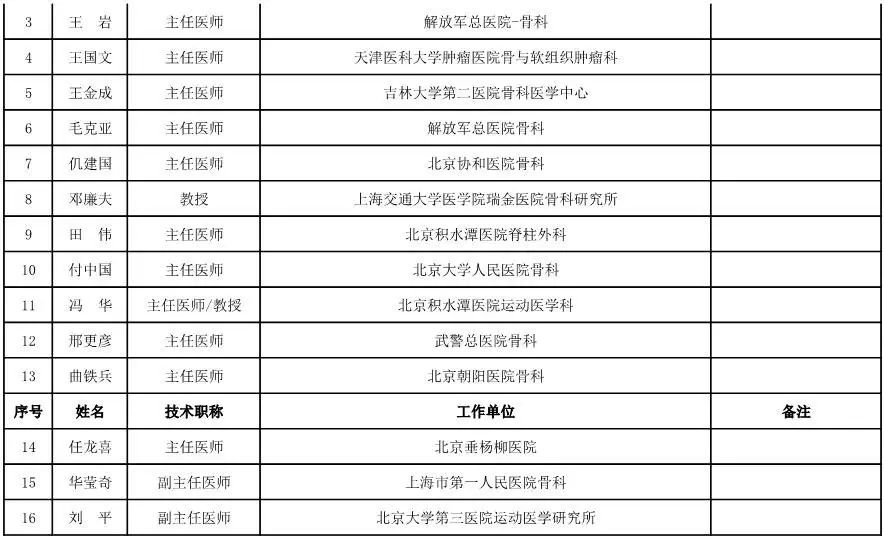
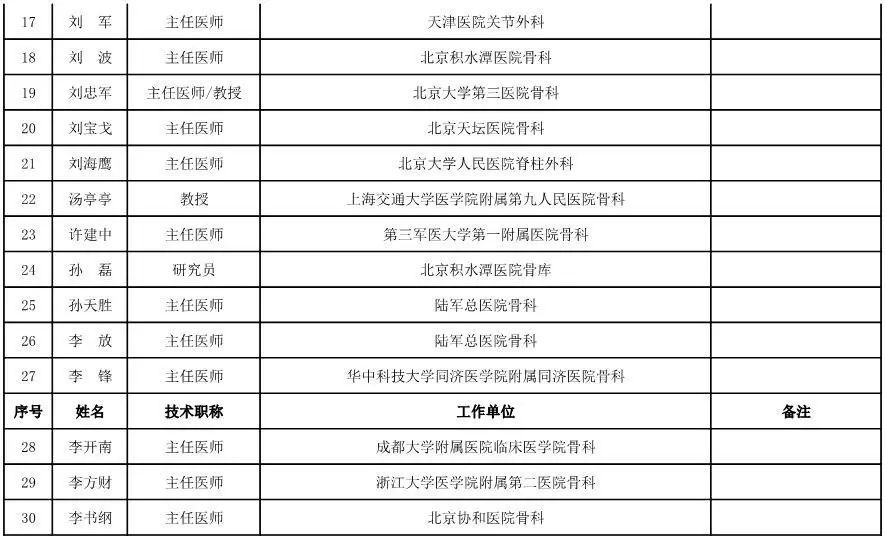
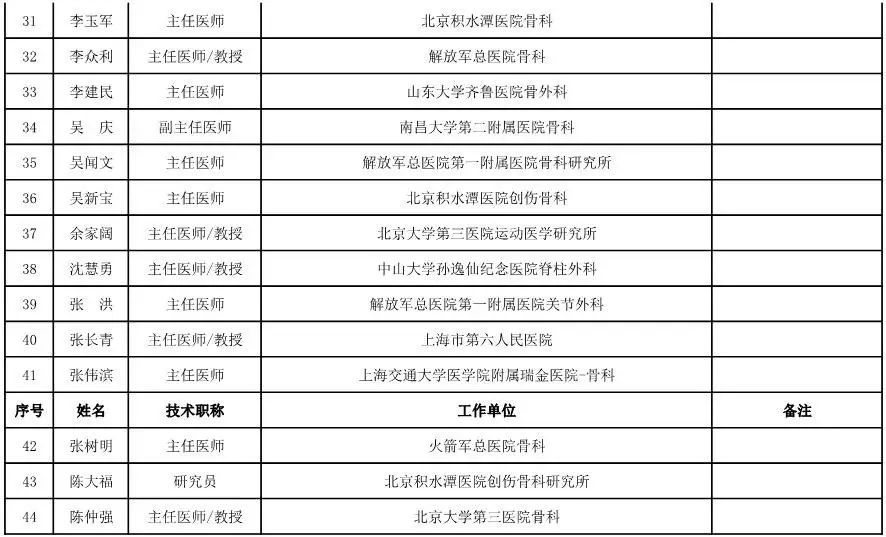
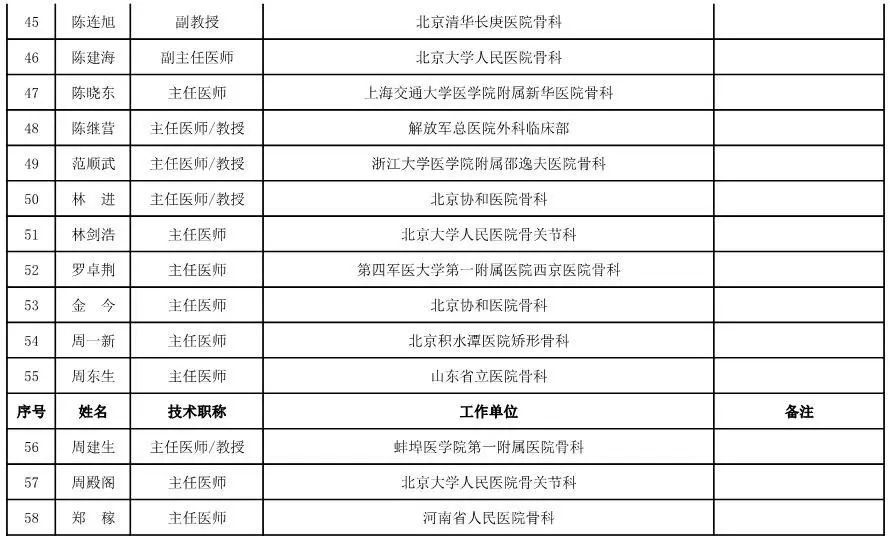
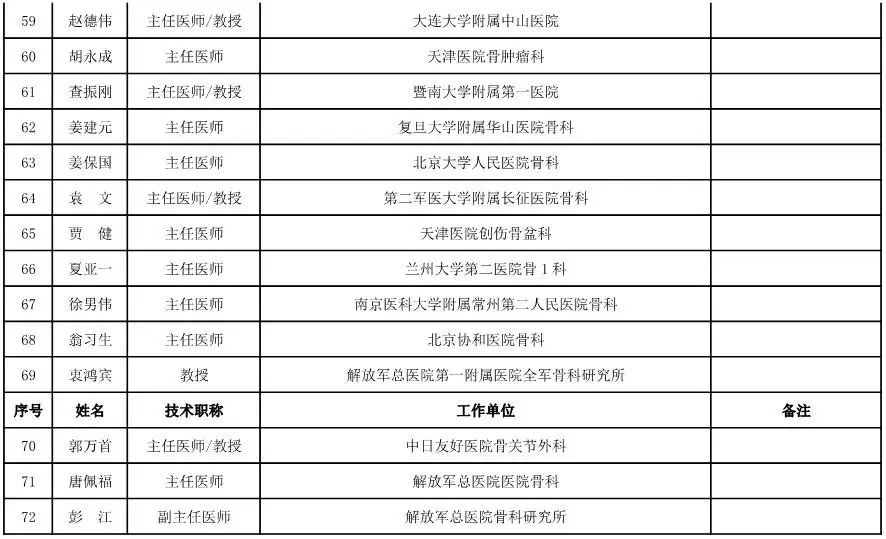
骨科用医疗器械专家咨询委员会候选人名单
(共78人,包含1名院士)

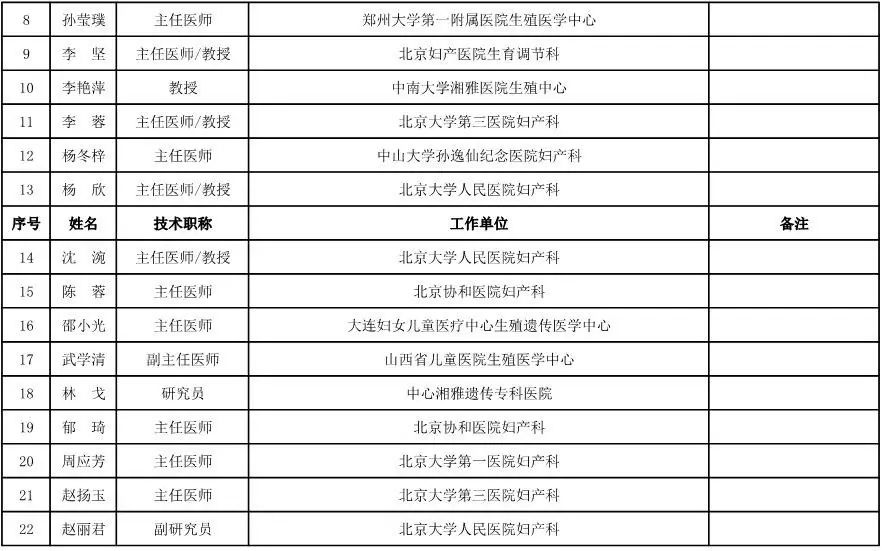
妇产科用医疗器械专家咨询委员会候选人名单
(共25人)


儿科用医疗器械专家咨询委员会候选人名单
(共10人)
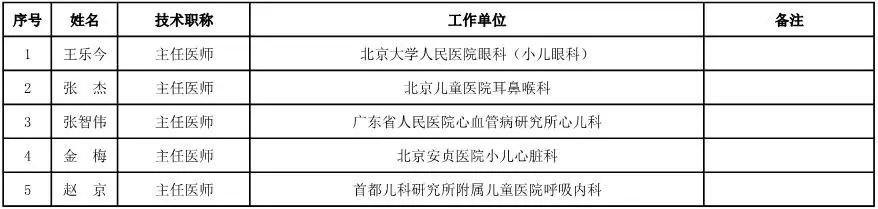

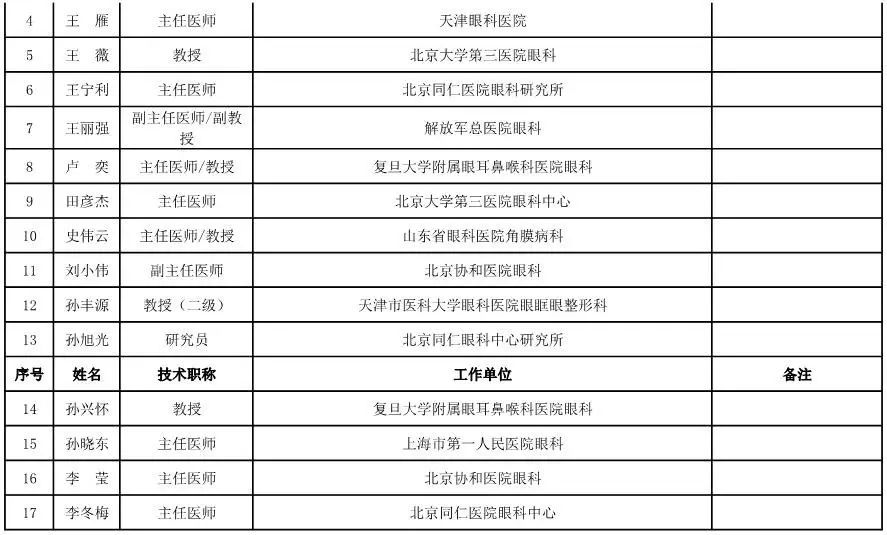
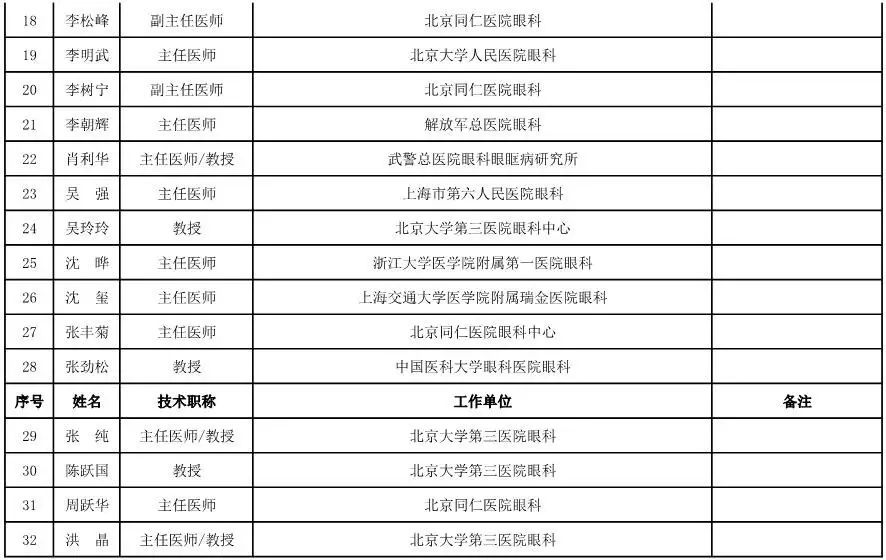
眼科用医疗器械专家咨询委员会候选人名单
(共42人,包含1名院士)