自从Monk团队报道术中低BIS(<45)的持续时间与术后死亡率存在相关性的文章后,学者们对于相对过深的麻醉就会导致患者死亡的可信度产生了怀疑。毫无疑问,这个假设引发了科学家们的广泛争论,同时麻醉学者们也在竭力寻求解决此问题的方法。首先,如果此假设成立,那研究中所涉及的导致患者术后死亡率增加的吸入麻醉药浓度,应在目前的临床治疗窗内。其次,如果小幅增加麻醉药的剂量,就会导致患者致命性损伤,那全麻与区域阻滞麻醉之间死亡率的差异将会显而易见。第三,临床上不同麻醉医生所实施麻醉的数量差异较大,如果上述假设成立,那就可以推测如果实施麻醉的医生不同,那患者术后的死亡率与并发症将差异明显。然而,多个研究表明由于麻醉学技术或麻醉医生不同所导致的不良预后,没有显著差异。
事实上,许多麻醉医生并不认同麻醉越深,不良反应就越多这一粗略的理念。而认为死亡率的增加,与患者脆弱性体质或是其对麻醉药敏感度的个体差异相关,可能更加合理。B-Unaware Study Group研究提示心脏病手术患者术中BIS<45的持续时间与术后死亡率相关,但是BIS<45的持续时间与挥发性麻醉药的使用时间增加无关。延迟挥发性麻醉药的使用时间也与患者术后的死亡率没有相关性。由于BIS<45与使用挥发性麻醉药总的时间之间没有相关性,B-Unaware研究组推测低BIS和1年死亡率之间的关系只是一个伴发现象,而其中涉及到的患者基础状况或是手术因素对术后1年死亡率的影响将有待阐明。
随后Sessler等做了大规模的队列观察研究提示,如果患者术中同时出现BIS<45,平均动脉压(MAP)<75 mm Hg与MAC < 0.8,则预示术后死亡率高。他们把此命名为“三低”,同时提示任一情况“双低”(低MAC和低MAP,低MAP 和低BIS,低MAC和低BIS)的累积时间对术后死亡有预警作用。在同一期的BJA杂志上,Maheshwari等对比了心脏手术患者术中“双低”(低BIS与低MAP)与术后死亡率的关系。经矫正协变量与多重比较后,表明长时间的“双低” (定义为BIS <43与MAP <75 mm Hg,或者二者其一是BIS <37或MAP <69 mm Hg)增加患者术后30天死亡率,同时“双低”与住院期间的死亡率及并发症的发生存在相关性。该文中所用的“双低“既没有基于生理学的调节机制(比如对BIS阈值的自身调节),也不是以前被推荐的看似为最佳的BIS <45与MAP <75 mm Hg时的阈值。而且此文中的“双低”值是使用粗略的的统计方法直接得出。同时此文中所使用的双低值MAP和BIS,低于所使用参数的平均值,也小于1个SD。
从绝对数值上界定低BIS或低MAP的临床意义则更具有争议。目前普遍认为围术期低血压造成的组织低灌注可直接导致组织与脏器的损伤。但对导致组织损伤的血压阈值界定也一直存在争论,有研究表明MAP <55–60mm Hg与组织损伤相关。然而,常规的安全血压范围并不适合所有患者,比如需要提高静脉压的患者,冠心病患者,脑血管病变患者,或者某些区域性血供减少的患者。这些患者往往需要很高的MAP以满足足够的组织灌注。个体化的血压目标导向管理就是根据患者临床或其他替代指标得出的基本情况而设定的。例如,大动脉手术的患者,大幅提高动脉压(目标:MAP >90mm Hg)可预防脊髓前动脉梗阻。再如,冠心病合并低血压患者,心电图提示ST段压低、心肌血供不足,此时使用升压药就可能改善心电图心肌缺血表现。
鉴于麻醉药物不像低血压那样可直接损害脑或其他脏器,故目前对“低BIS”这一概念本身就存在争议。首先,缺乏证据论证单一的BIS值具有特殊的神经生理学意义,其次,为何必须要用某一特定的BIS阈值来界定损伤。我们知道,与“双低”(低MAP与低BIS)相关的假设是,机体循环血容量不足时,脑灌注不足,从而引起BIS降低。事实上这种可能性也不大,因为用“低BIS现象”来预测脑灌注其特异性差、阳性率低。
对于存在严重争论的科学问题,研究结果的可重复性显得尤为重要。有些研究无法重复低BIS、低MAC与低MAP这三个指标单独或同时存在时,其与患者死亡的相关性;但也有研究证实他们之间存在相关性。对此,Goodman等拿出了一个有效地评价此类研究的初步框架,并提出一个判断这类研究是否可被重复方案。众所周知,如需确认实验的可重复性,不仅实验结果必须可重复,实验方法与和结论也需要可以重复。实验方法的可重复性差是这些有关“三低”研究的一个缺陷。例如,这些研究包含不同变量的回归分析(比如包括肿瘤指标),但是对所涉变量下限的定义不统一(比如:对低BIS,低MAP,低MAC所设定的阈值下限不同)。甚至有些科学家把“三低/双低”当作因果关系,而另一些科研人员则认为这种联系只是某些疾病的一种表象。然而在目前所涉及的科学的可重复性与“低”参数值之间关系的的研究中,其主要缺陷在于BIS的计算方法不固定。
血压的计量单位(mm Hg)可以在同一患者以及不同患者间比较。也就是说75 mm Hg的MAP,在1997年与其在2017年意义是一样的。同样吸入麻醉药的浓度也可以被准确的测量,比如在压强2 KPa时同一七氟烷浓度,无论在加德满都、在丹佛、在伦敦,其临床意义与药理学作用都是相同的。所以尽管既往认为 BIS是反映麻醉深度,或者麻药对大脑影响的可靠方法,但我们现在知道这不总是正确的。既往,以线性尺度的方法从100到0划分镇静深度过于简单,也不符合生物学原理。已有许多研究提示BIS值不可靠。与MAC和MAP不同,BIS没有度量单位,同时由于BIS计算方法不断被校正,故其缺乏可重复性。比如,45的BIS值在2017年很可能与其在1997反映不同的脑电特征。已有研究表明BIS值对同一患者也缺乏重复性,比如用两台BIS仪监测同一全麻患者,一台可能显示麻醉太浅,而另一台则提示麻醉过深。BIS值并不随麻醉药浓度的增加而呈线性下降,有时反而会升高。BIS值偶尔也会随吸入麻醉剂的浓度增加而反常升高。在用BIS值指导麻醉深度的评估时需要特别注意的是,BIS值可以被颅外电信号动所误导。比如脑电图表现为持续性抑制状态,但是由于受到心电或肌电活动(或其他来源的信号伪差)干扰,BIS值提示患者麻醉深度适当合理或是不足(图1)。最能说明依赖BIS指导来滴定麻醉深度之间关系的文章,是近期Schuller团队的研究结果,他们只使用一种肌松药(司可林或罗库溴铵)就可使BIS值降至40。此项研究清楚地表明全麻或使用肌松药就可降低脑电活动,使BIS值下降到符合全麻深度。因此就可能出现完全清醒但肌松完全的患者,BIS读数显示其麻醉深度是合适的。总之,不能再认为BIS低于60,或预防性的减少全麻药用量使BIS大于60,就是安全的了。
综上所述,Maheshwari团队研究证明心脏手术患者,术中同时出现长时间的MAP <75mm Hg和BIS <43(MAP <75mm Hg和BIS <37或者MAP <69和BIS <43)可能使患者术后的并发症或死亡率增加。这是一个非常重要的发现,这些研究表明围术期细微的管理变化都有可能影响患者术后的长期预后。然而纵观既往的研究,由于观察性研究的限制,同时这些同类研究其方法学也很难统一,故很难得出结论。虽然MAP <75mm Hg(或者 69mm Hg)是一个通用的阈值,但对于心脏病手术患者来说,可能需要更高/更低的血压以维持合适的组织灌注。故所有依赖于BIS的临床研究都会由于BIS的频繁误读而受影响。是时候将我们从BIS和其他滴定麻醉深度的指标中解脱出来了。用于围术期监测的特异性脑电信号必须具有可重复性,比如可预测患者不良预后的脑电抑制波。当这些特征性的脑电信号与低MAC或低MAP同时发生时,其相关性就会非常显著。麻醉医生应当学会阐释、鉴别不同脑电图特征,而不是依赖于那些易引发混淆清的,专有的,不可重复的指标。
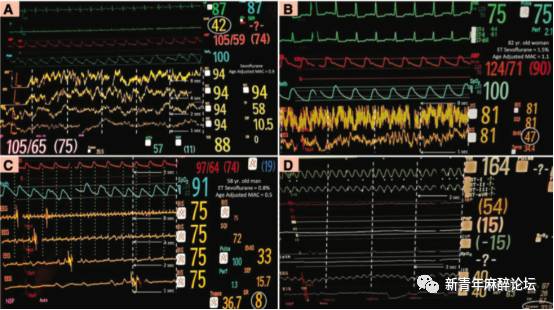
图1 前额脑电图(EEG)和BIS值的差异表达。(图A和图C)前额EEG描记的走纸速度(6.25、12.5、25和50mm/s)。(图B)前额EEG描记的走纸速度(6.25和50mm/s)。(图D)前额EEG描记的走纸速度25mm/s。脑电图波形符合使用七氟醚全麻的特点(δ波在0~1 Hz与α脊波交叉耦合在0~10 Hz (图A)0~12 Hz(图B)。吸入麻醉药的浓度符合此波形特点。BIS值在94(图A)与81(图B)读数有误,这可能是由于高频信号伪差所致,这种在EEG中可见的信号伪差可能影响肌电图(分贝)和BIS值。脑电图(图C)呈现偶见棘波的广泛抑制。此图中BIS为75时其读数有误,很可能由于异常的ECG导致的EEG描记错误所致。这可从正常脑电波的峰值动脉压峰值相一致这点上来参考。D图中脑电波呈现持续性抑制,这些是深麻醉、低温,或其神经病理学改变时的脑电波特征性改变。同样BIS在40时具有误导性,很可能归因于异常ECG导致EEG描记错误。





