
胶质瘤是最常见的脑内肿瘤,临床表现主要包括颅内压增高及神经功能异常。目前,主要依靠MRI和CT对其作出初步的影像学诊断。今天,北京协和医院放射科冯逢教授将为大家介绍胶质瘤诊疗的MRI多模态评价相关问题。
来源 | 医学界影像诊断与介入频道
胶质瘤基因分型
胶质瘤是最常见的脑内原发性肿瘤,分子生物学研究发现其病理分级与肿瘤内微血管密度(MVD)的疏密密切相关;同时胶质瘤也是一种异质化肿瘤,在同一肿瘤内部,各区域可能存在不同的分化特征级别,术前测定胶质瘤内部微循环灌注情况对其分级及评价疗效、预测生物学行为有重要价值。
2016年,世界卫生组织颁布了最新版中枢神经系统肿瘤分类,其中胶质瘤新的诊断标准从原来单纯的组织学层面的分类,上升到分子-基因水平上的分类:
1.仍然保留了组织学分类+基因分型;
2.大幅度地重建了“弥漫性胶质瘤”、“髓母细胞瘤”、“胚胎性肿瘤”的概念;
3.删除了“大脑胶质瘤病”、“PNET”、“混合性星形细胞瘤”的名称;
4.增加了“弥漫中线胶质瘤,H3 K27M–突变”的名称;
新的分类标准更好地理解肿瘤的发生、发展及转归,有利于治疗方案的制定。
中国胶质瘤诊断和治疗指南中影像学评价也占据了非常重要的作用:影像学评价应包括检查流程、诊断、分级、治疗后评价,建议HGG,术后≤72小时,进行基线的增强MRI检查;LGG,术后任何时间至12周,进行T2/FLAIR检查。
胶质瘤治疗的影像学评价
近十年来,胶质瘤的治疗有了很大的进步,随着新治疗方法的引入,胶质瘤治疗后影像学评价也出现了新的变化。充分认识这些变化,对临床胶质瘤患者总体治疗方案的确定和修正非常重要。
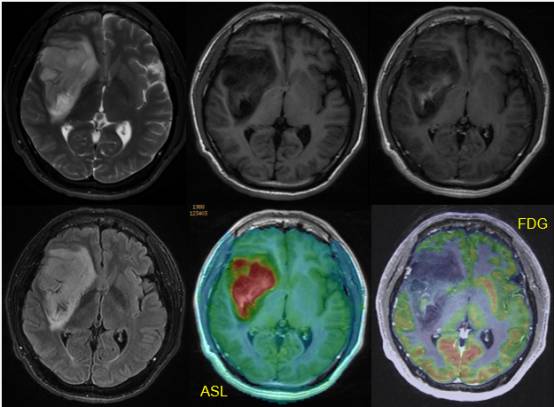
上图是右侧导叶胶质瘤患者影像学检查结果,对比剂增强结果显示,病灶内有不太均匀的强化,灌注检查显示病灶有明显灌注增加,提示肿瘤内部有很多新生血管。PET-MRI检查显示FDG在某些区域有浓聚,该患者影像学征象都提示是较高分级胶质瘤。
患者同步放化疗后,后续影像学监测及术后得到的分级病理提示它是一个IDH表达的有突变且1p/19q缺失未表达的分子基因类型,是低分级的弥漫性星形细胞瘤 。提示基因型于胶质瘤预后是有直接的影响的,IDH野生型胶质瘤中无论哪种胶质母细胞瘤预后都是比较差的。
新的胶质瘤治疗方案会出现一些治疗引起的反应,这些反应在常规检查方法中不太容易鉴别。这样的情况下,包括扩散加权成像、DWI灌注成像、注射对比剂DSC(动态的磁敏感)对比成像以及不需要注射对比剂的动脉自旋标记成像ASL等新的检查技术,都被用于手术后同步放化疗后以及化疗后的肿瘤评价中。
冯教授及其团队近期在J-MRI杂志上发表了一项针对复发高分级胶质瘤的研究结果提示,在基线检查中除了要做常规的平扫+增强扫描外,还需要增加MR功能检查的序列。这样得出的半定量评价指标对患者的治疗效果以及预后都会有一个很好的提示作用。
影像学征象和病理分型的关联
目前有提示性作用的影像征象相对较少,只是在一些常规影像上表现为低分级胶质瘤,但在术后和治疗后快速进展的病例中,影像特征有一定提示作用:低分级胶质瘤扩散是明显受限的,ADC值偏低,其他形态学征象提示为低分级胶质瘤,但若术后快速出现复发进展,结合基因分型更多的符合IDH野生型。
还有一些研究显示, IDH突变低分级胶质瘤更多出现在额叶和岛叶区域,而在IDH野生型高分级胶质母细胞瘤,它的分布并没有显示出明显的特征,可能会出现在任意的一个脑区。
下面是一个MDT的病例:
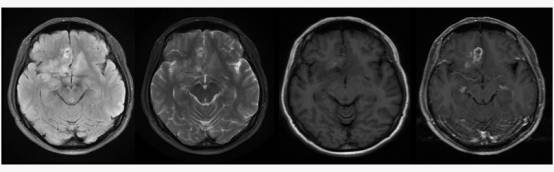
这是一个女性43岁患者的影像学检查结果,主诉是阵发性恐惧感,9个月头疼 ,恶心乏力。患者双侧额叶有弥漫的异常信号区域,边界不清,对比剂增强后影像学诊断提示是高分级胶质瘤,患者切除额叶高级别胶质瘤的切除术后,症状明显好转。术后进行了同步放化疗,后又出现了惊恐发作和头疼症状,再次影像学检查结果如下:
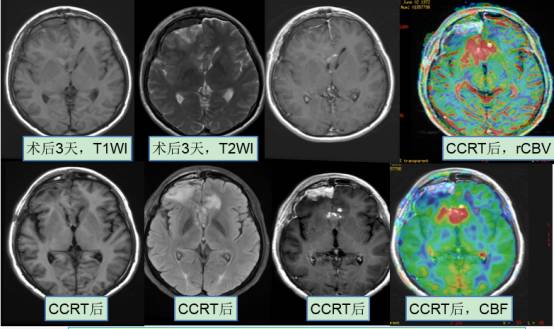
术后3个月灌注成像发现有明显异常强化区域,无论是注射对比剂的DSA的DSC灌注中,还是不注射对比剂的ASL灌注中都发现了异常强化的区域有明显的血流灌注的增加,提示肿瘤复发。结合分子基因病理结果,患者无IDH基因表达,提示它是一个原发的胶质母细胞瘤,同时没有MGMT甲基化表达,提示患者同步放化疗的效果不佳,是预后非常差的胶质瘤。
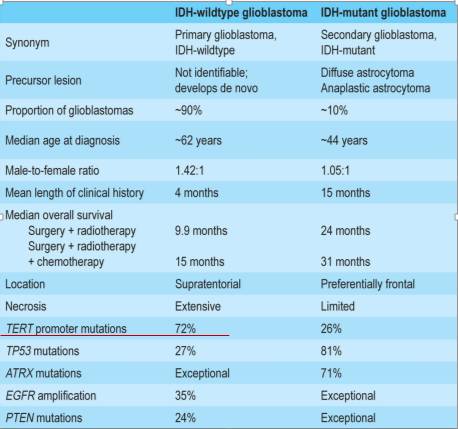
WHO分型中可见原发的IDH野生型胶质母细胞瘤和IDH表达的胶质母细胞瘤
平均生存时间以及总生存时间上都有显著差异,野生型预后较差。
冯教授最后总结道,目前对于胶质瘤尤其是术后同步放化疗诊治的过程中应包括全面的磁共振成像检查:包括平扫T1、T2(尤其是T2 Flair序列),对比剂增强常规成像,灌注成像、扩散加权成像或者病灶的MRS,只有在比较全面的磁共振检查基础上,我们才能够较好地评价治疗后变化,对胶质瘤的治疗才能有更好的提示。






