
骨关节炎在老龄化人群中的患病率不断上升,这迫使人们不得不使用先进的生物医学治疗方法。这些治疗方法包括移植或递送被支架包裹的药物分子。然而,由于药物分子的半衰期较短和脱靶效应,此类治疗方法通常无法达到最佳治疗效果。
作为应对措施,
来自加拿大韦仕敦大学的Arghya Paul团队
开发了一种基于3D打印的水凝胶组织修复平台,其中包含来自分化哺乳动物细胞的去细胞化细胞外基质(dECM)作为治疗物质。在此,小鼠成骨前细胞和软骨前细胞在体外分化、去细胞化,并掺入甲基丙烯酸酯明胶(GelMA)溶液中,分别形成成骨(GelO)和软骨(GelC)水凝胶。
图1描述了制造3D打印多层支架所涉及的步骤,该研究有助于推进骨软骨组织修复的组织工程方法。相关研究成果以
“In Vitro Engineered ECM-incorporated Hydrogels for Osteochondral Tissue Repair: A Cell-Free Approach”
为题于2025年1月5日发表在
《Advanced Healthcare Materials》
上。
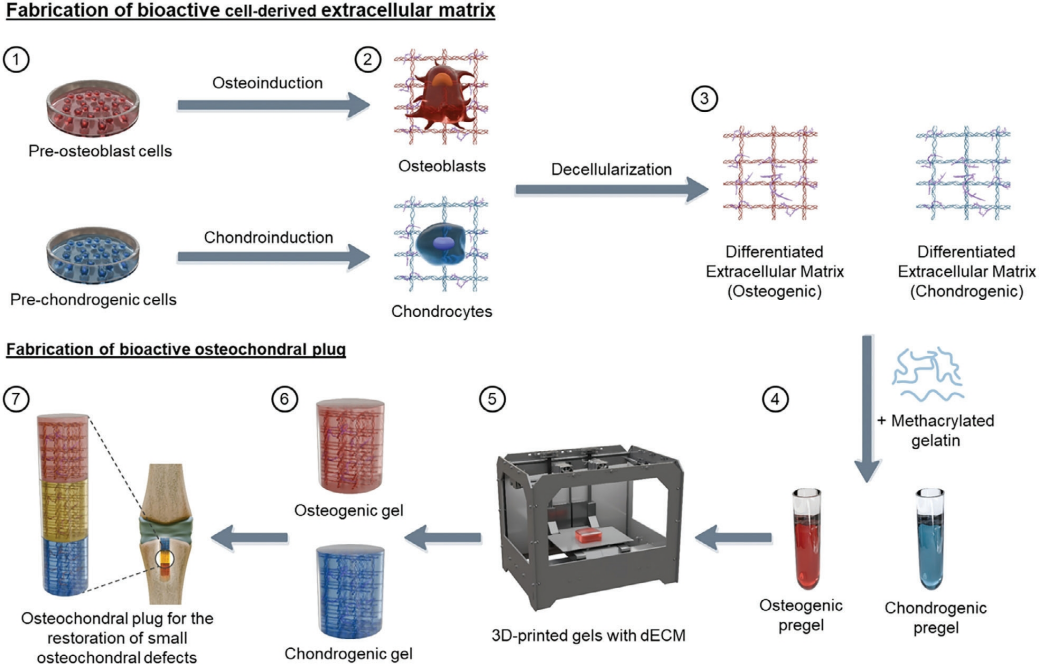
图1 插图展示的是含有dECM的3D打印多层水凝胶用于骨软骨修复
1.分化的MC3T3-E1细胞衍生的OdECM能够在hASC中诱导无药物成骨
作者首先对从分化的MC3T3-E1细胞中提取的OdECM进行了表征和评估。
图2A显示了使用DAPI染色成功去除细胞物质,表明脱细胞过程的有效性。SEM图像分别显示了来自分化(+)和未分化(-)MC3T3-E1细胞的dECM之间的结构差异,例如矿化(图2B)。dECM 结构的这些差异可能归因于细胞分化对 dECM 组织和组成的影响;EDS显示OdECM中钙和镁等矿物质沉积量相对较高(图2C)。图2D中的茜素红染色证实了分化的OdECM的矿化潜力。通过从ARS中提取染料量化了各组中的相对钙水平,分化的dECM组中钙水平高出约6倍,表明其矿化能力优于未分化组(图2E)。
分化的dECM组中的阳性染色和更高的钙沉积进一步支持了其作为骨组织工程支架的潜力
。RT-qPCR分析研究了用不同浓度OdECM处理的hASC中成骨标志物(OPN和OCN)的表达,分析发现浓度为0.4% (w/v)的OdECM成骨标志物表达最高。因此,所有其他实验均使用0.4%的浓度。
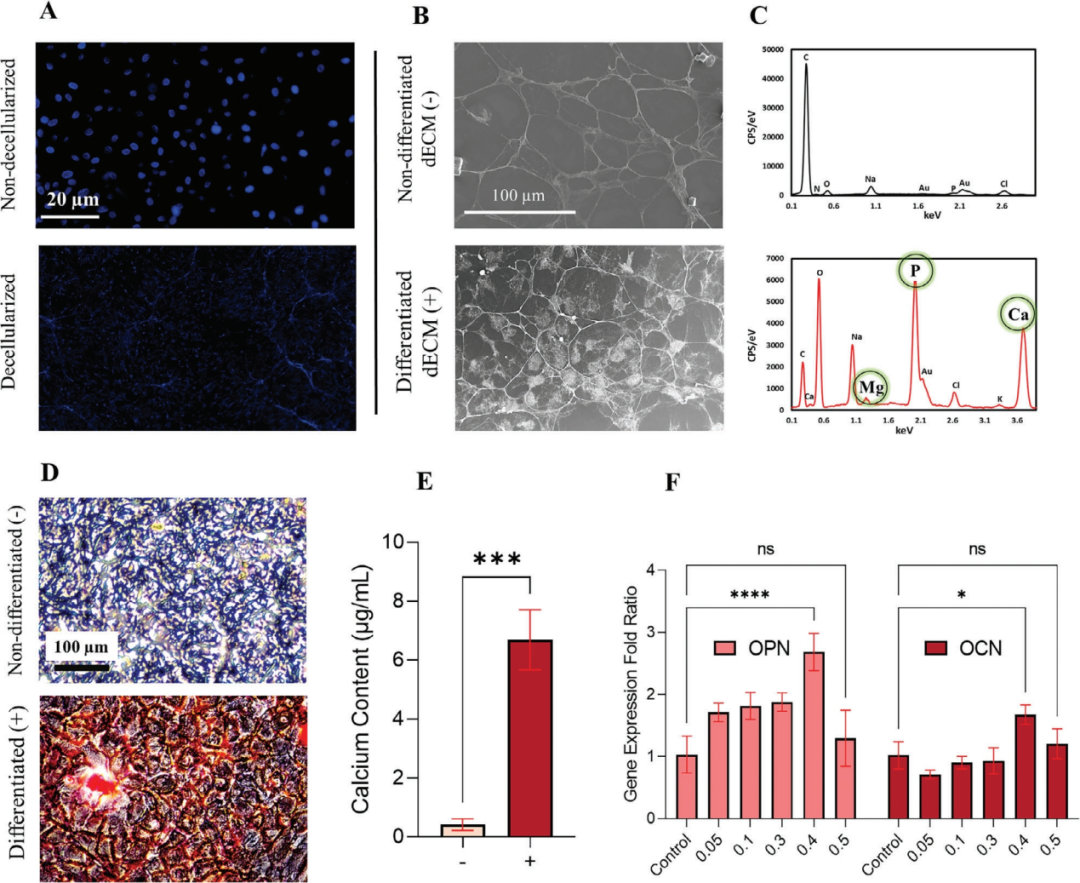
图2 来自分化MC3T3-E1细胞的生物活性OdECM可诱导hASC中的无药物成骨分化
接着,作者按照上述方式对分化的ATDC5细胞衍生的CdECM在hASC中诱导无药物软骨形成进行了研究(图3)。结果表明,源自分化ATDC5细胞的dECM含有软骨形成因子,可增强hASC的软骨形成潜力并影响干细胞向软骨形成表型发展的行为。
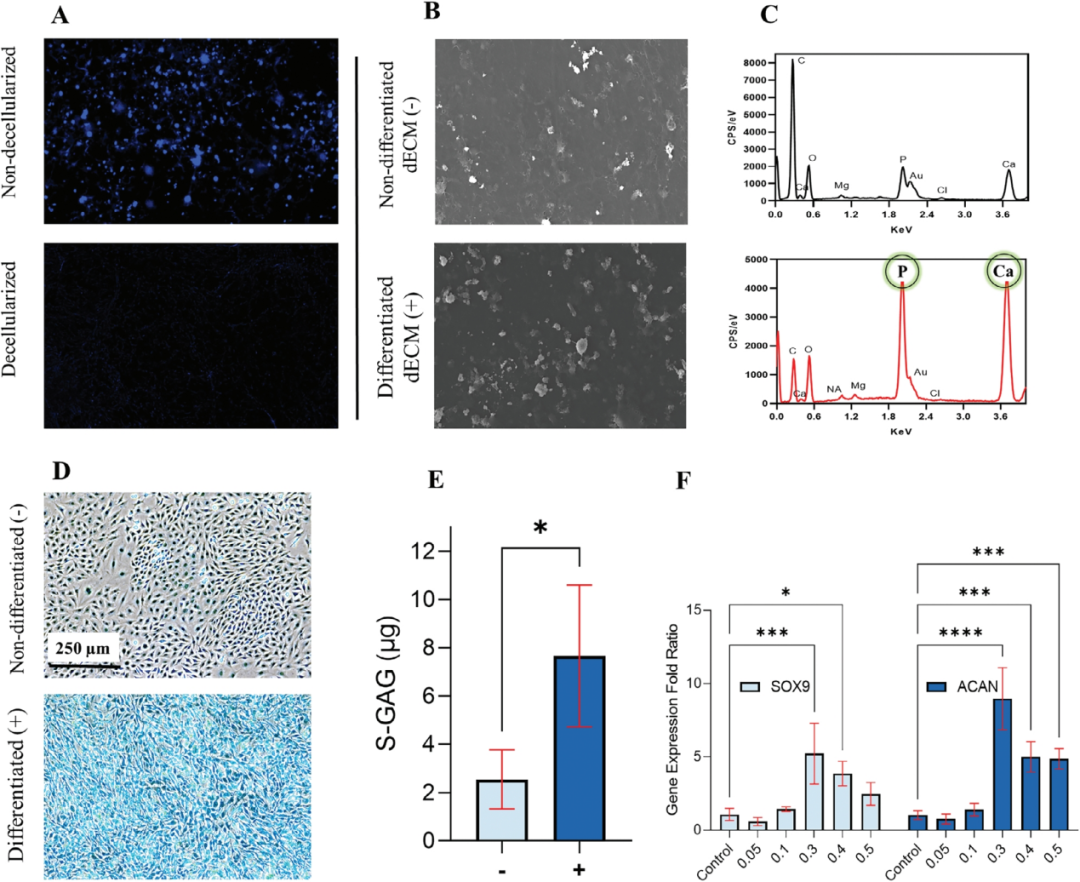
图3 ATDC-5细胞中的生物活性CdECM可诱导hASC中的无药物软骨发生分化
2.蛋白质组学分析
为了进一步研究成骨和软骨ECM背后的潜在分子机制,作者使用高分辨率MS技术进行了蛋白质组学分析
。
维恩图显示在Od/非OdECM样本中共鉴定出4326种蛋白质,其中303种蛋白质是OdECM独有的(图4A)。热图显示与非OdECM组相比,OdECM组的主要骨ECM结构和信号蛋白总体过度表达,表明ECM环境更具成骨性(图4B)。蛋白质组学分析显示,COL2A1上调至1.4倍,具有高度显著性,表明与非OdECM相比,OdECM中含有更多类似骨的ECM成分。非胶原蛋白在促进成骨分化、骨形成和骨ECM信号传导中也发挥着至关重要的作用。如火山图所示,与非OdECM相比,OdECM中发现大量非胶原骨ECM蛋白显著上调(图4C)。基因本体论(GO)富集结果显示,生物过程中骨形成(骨化)、细胞成分中ECM和胶原蛋白以及分子功能中ECM结构成分显著上富集(图4D)。
总体而言,OdECM中的蛋白质谱显示出骨模拟ECM蛋白质组成,这与体外实验的成骨结果一致。
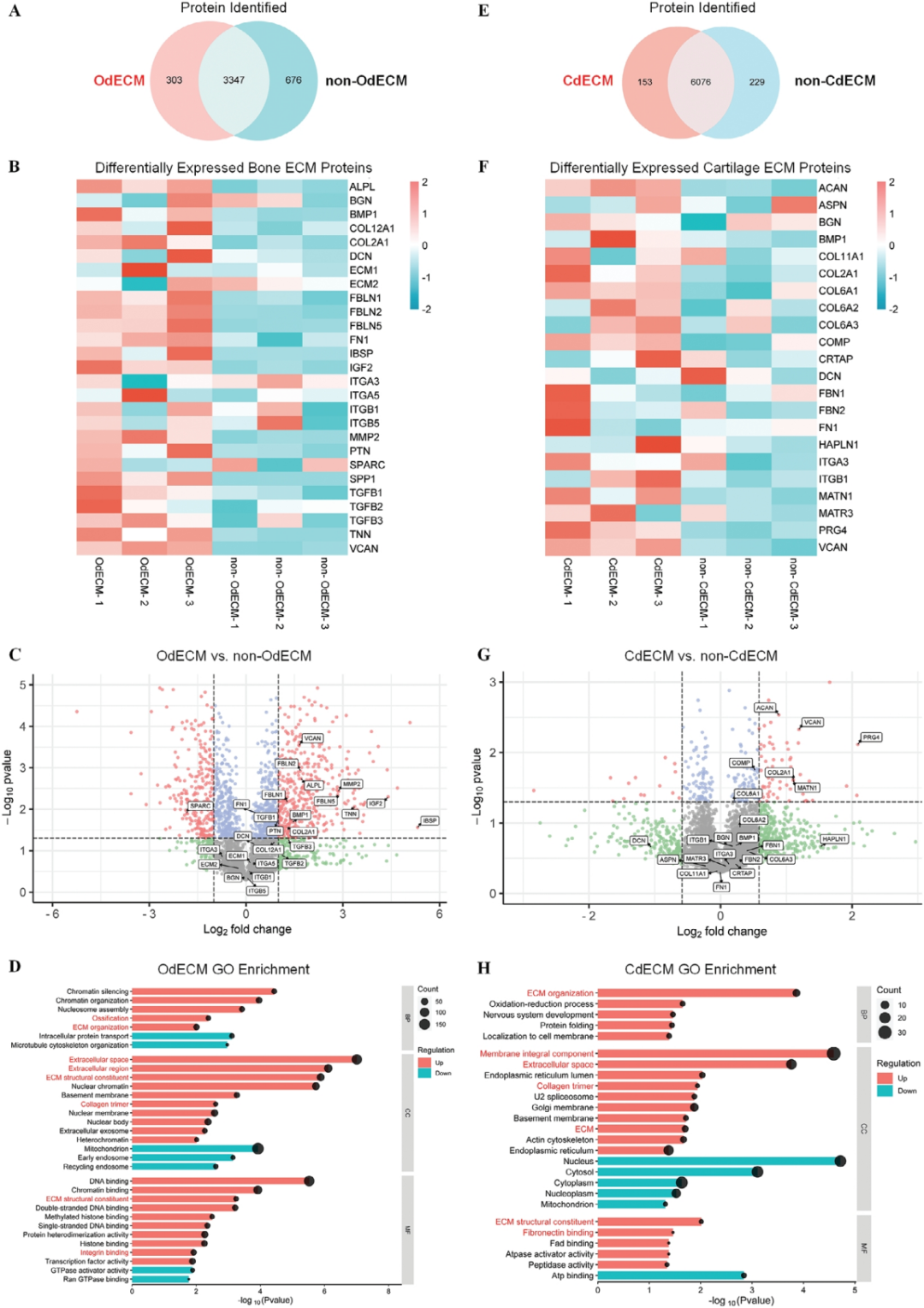
图4 OdECM和CdECM的蛋白质组学分析
3.OdECM和CdECM集成到GelMA中打印
利用3D打印将GelMA、OdECM和CdECM集成到一起(图5A)。SEM显示所有水凝胶中都有大孔空隙空间,表明它们具有3D网络结构。水凝胶的互连多孔结构为细胞浸润、增殖和组织再生提供了有利的环境。水凝胶具有稳定的溶胀行为,可能是dECM的存在会限制水渗透并产生更紧凑的水凝胶结构(图5C)。流变测试表明三种水凝胶表现出非常相似的流变特性,具有良好的机械性能(图5D)。单轴压缩试验进一步表明dECM的存在有助于水凝胶基质的整体增强。dECM的整合可能会产生一种复合材料结构,结合两种成分的机械性能,从而产生更硬、更坚固的水凝胶。作者还测定了韧性以评估水凝胶在受到压缩力时抵抗断裂的能力(图5G)。结果表明,与不含dECM的水凝胶相比,加入OdECM和CdECM略微提高了GelO和GelC水凝胶的韧性。
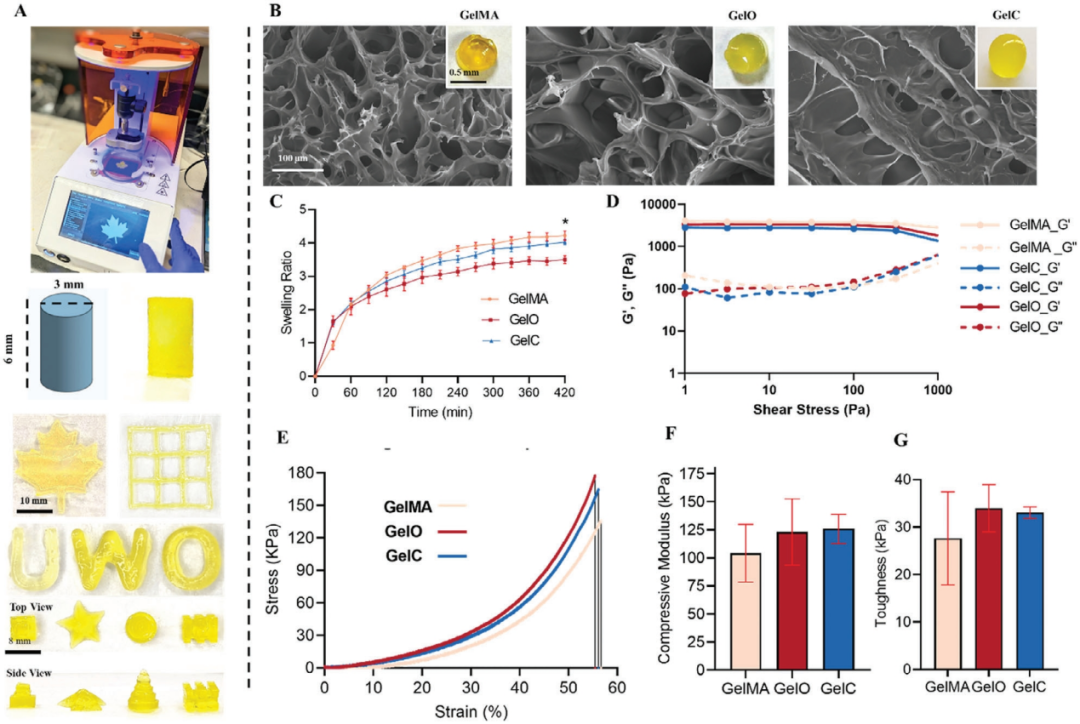
图5 3D可打印GelMA递送生物活性OdECM和CdECM
4.GelO和GelC联合使用可同时诱导hASC中的成骨和软骨形成
成骨和软骨形成是骨软骨组织修复中的重要过程。使用基于水凝胶的治疗方法促进干细胞分化为成骨细胞和软骨细胞的能力令人十分感兴趣,也是本研究的最终目标。
作者评估了三种不同的水凝胶组合(Gel-GelO、Gel-GelC、GelO-GelC)在诱导成骨和软骨分化方面的有效性(图6)
。
实验设计涉及薄层水凝胶治疗的横向沉积,并使用基因表达分析来量化分化结果。该装置包括一个24孔板,中间插入一个塑料密封壁,形成单独的隔间(如图6A所示)。使用的三种水凝胶类型是GelMA、GelO和GelC。使用蓝光对水凝胶预混物进行光交联。将hASC接种在水凝胶顶部并培养21天,以进行成骨和软骨分化。为了评估成骨作用,对Gel-GelO样品进行了茜素红染色(图6B)。GelO侧呈现鲜红色,表明存在钙沉积。相反,GelMA侧呈现有限的红色染色,表明成骨分化最小。该结果表明GelO在促进hASC成骨分化方面比GelMA更有效。为了评估软骨形成,对Gel-GelC样品进行了阿尔新蓝染色(图6C)。GelC一侧呈现亮蓝色,表明硫酸化蛋白聚糖沉积,这是软骨形成的典型特征。另一方面,GelMA一侧呈现有限的蓝色染色,表明软骨形成分化有限。这一发现表明,与GelMA相比,GelC在促进同一孔内的软骨形成分化方面更有效。
为了量化成骨和软骨标志物的表达水平,对用不同水凝胶组合处理的hASC进行了RT-qPCR分析(图6D),结果与茜素红和阿尔新蓝染色的结果一致,表明GelO和GelC有效促进hASC中的谱系特异性分化。
















