2017
年
5
月,《
Cell
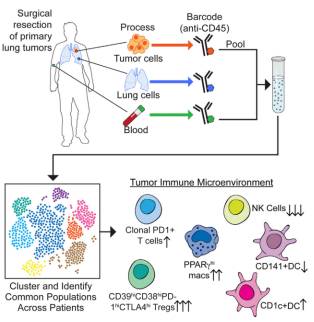
》杂志连续刊登了美国西奈山伊坎医学院研究人员的工作,他们分离了来自肺癌病人
肿瘤
组织、正常肺组织以及外周血的免疫细胞,利用
TCR
测序和质谱流式(
CyTOF
)等技术对细胞特定转录本和表面30多个蛋白
Marker
进行检测分析,绘制了早期肺腺癌肿瘤微环境中免疫细胞的详细图谱。根据测序比对和质谱流式的分析结果,发现早期的肿瘤就已经开始在改变其微环境中的免疫细胞组成和表型了,尤其是T细胞、天然杀伤细胞和
肿瘤
浸润髓系细胞(
TIM
)。
数据结果
作者利用
Phenogragh
(一种以
Unsupervised
方式进行细胞分群的
生物信息学
分析工具),将
T
细胞(
CD3+ cells
)分为
21
个具有不同表面
marker
表达模式的亚群 :
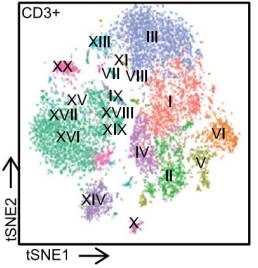
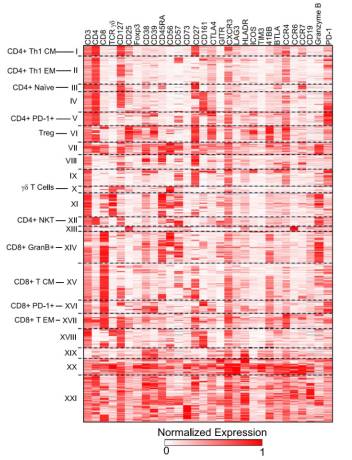
通过对这些亚群各个
Marker
的表达情况我们可以得知,其中有的亚群对应于我们已知的一些
T
细胞亚群,例如亚群
I
是
CD4+ Th1 CM
,亚群
VI
是
Treg
,但还有一些以前传统手段未识别出来的新亚群(例如亚群
IX
、
XX
等)。
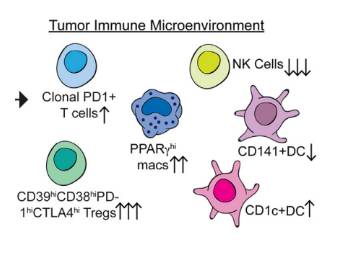
通过对比这些亚群在不同样本中的比例,作者发现亚群
VI
(
Treg
)、亚群
V
(
CD4+PD1+T
)等多个亚群特异的出现在肿瘤组织中,提示这些亚群与
肿瘤
的发生过程有着密切的联系。
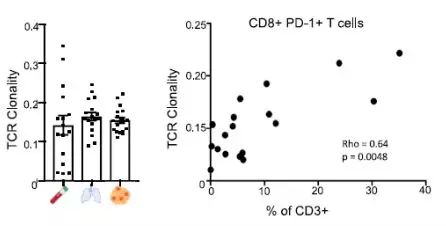
作者接下来进一步研究了
肿瘤
组织中靶向分子
PD-1
与不同
T
细胞亚群间的关系。数据显示
PD-1
仅在
肿瘤
组织
CD4+
和
CD8+
细胞中显著表达;通过
ImmunoSEQ
方法对细胞样本
TCRbeta
链的
CDR3
区域进行测序,分析发现虽然在
肿瘤
组织和正常肺组织中总体的
TCR
克隆型并无明显差异,但是在
肿瘤
组织中
TCR
克隆的形成和扩增明显和
CD8+PD-1+ T
细胞亚群特异性相关,且多发于
TLS
富集的
肿瘤
病灶区域,该现象在正常肺组织中并未观察到。
同样,作者用类似的方法分析了
CD3-
细胞,将
B
细胞和髓系细胞精细的分为了
20
个亚群,通过对比这些亚群出现在不同组织的比例,作者发现了在
肿瘤
组织和正常肺组织内免疫细胞亚群构成和功能的巨大差异。例如,
DC
细胞(也成树突状细胞)在诱导
肿瘤
免疫的过程中发挥了重要的抗原递呈作用。在这项研究里,这类细胞被分为两个表型不同的亚群:
CD141+DC
和
CD1c+DC
,转录组数据表明两群细胞具有不同的活性,相比之下,除了细胞表面的一些重要的免疫功能相关受体有表达有差别外,前者的溶酶体相关基因具有更高表达水平。经过统计,作者发现
CD141+DC
在
肿瘤
组织中的比例显著低于正常肺组织,而
CD1c+DC
则差异不大。
与
T
细胞的结果类似,
DC
细胞亚群和功能的变化也反映了
肿瘤
组织中免疫细胞功能的失调。后续的分析表明,类似的变化还出现在NK细胞、单核细胞(
Monocyte
)、巨噬细胞(
Macrophage
)等细胞类型。这些信息汇总起来,充分说明肺癌
肿瘤
免疫微环境的系统性改变。以往的研究,一般专注于
T
细胞功能的改变,这项研究是对已有肿瘤免疫理论的重要补充和细化。相应的,在
肿瘤
的免疫治疗领域,主要也还是以激活
T
细胞为主(例如
CAR-T
,各种免疫检查点类的抗体药物),如果能采取措施活化
肿瘤
组织浸润的髓系细胞加以配合,很有可能大幅提高免疫治疗的效果。
研究意义
尽管该研究尚未直接改变目前的癌症治疗方案,但来自
Dana-Farber Cancer Institute
的
免疫学
家
W. Nicholas Haining
教授指出,该研究的重要性绝不局限于具体的实验结果,而在于所拓展的研究方向——
肿瘤
微环境中免疫细胞组成对患者预后的指示性作用及对癌症治疗的指导意义。
“我们需要对数百名癌症患者、数十种
肿瘤
类型进行研究,达到对每个样本要能分析数千个免疫细胞的水平,”他说道:“这是我们为了解这背后的生物学机制所必须做的。”
如何对细胞亚群进行精确细分?
已有报道数据显示,目前仅以一到两种蛋白质的表达来推断
T
细胞或巨噬细胞状态的做法,很可能会遗漏掉重要的信息(
ref2
)。传统方法多用流式细胞分析技术对细胞进行亚群分析,然而由于方法学上的限制,目前在单一样本上很难进行数十种参数的同时检测。
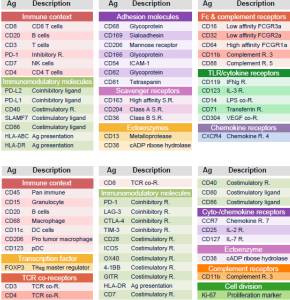
肿瘤
相关巨噬细胞(上)和T细胞(下)分型的蛋白标记物(
ref2
)
Fluidigm
公司的质谱流式专利技术,利用
金属元素标签
进行抗体标记,大量去除背景噪音对实验结果的影响,并有效避免了传统方法下检测信号间的交叉重叠,无需荧光补偿。利用
Helios
质谱流式细胞仪可对样本同时进行
超过40 种参数
的高效检测,不仅可用于常规样本检测,更可解决某些临床珍贵样本量少的问题;同时通过单样本多参数检测,可对数据结果进行全面综合分析,避免了“盲人摸象”现象的产生。
另一方面,在
T
细胞研究中,
TCR
a、b链上的可变区域序列信息是分析
T
细胞克隆亚型的关键信息之一,其多变性和复杂性往往对T细胞分群和功能研究造成很大影响。区别于文章中所用的ImmunoSEQ方法仅针对群体细胞样本TCR的
3’-end
和
CDR
区域进行检测,
Fluidigm
公司与
Sanger
和
EMBL-EBI
等机构在单细胞水平合作开发了新的TCR序列分析方法——
TraCeR
(ref3)
, 该方法通过
C1
系统制备
单细胞全转录组
后进行测序分析,数据不仅可以提供
TCR
全部可变区域序列信息,更可进行
TCR
全长序列分析,基于该分析结果能够准确、细致鉴别各种环境下的
T
细胞克隆亚型,对样本中复杂的T细胞群的表型和功能进行精确分析。该系统实现了从细胞捕获到核酸制备全部过程的自动化,可快速制备单细胞全转录组、全基因组及靶向序列的核酸样本。
文章来源:生物谷







