实验方案(图1A):在第0天,从糖尿病NOD小鼠中分离所需材料,将MSC,EVs(3mg或30mg)或PBS通过静脉注射IV的方式,注射进入NOD / scid小鼠
(
非肥胖糖尿病/重症联合免疫缺陷)
。在第4天,再次治疗。予高糖喂养,每周进行两次高血糖监测,具有血糖>250mg/dL的小鼠定义为糖尿病,如(图1B)所示, MSC衍生的EVs和MSCs两者都显着延迟了T1D模型小鼠T1D发病时间。
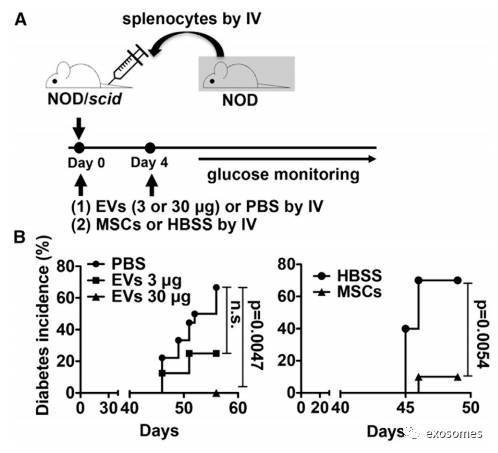
图2: MSC衍生的EVs在胰岛中抑制胰岛炎
(图2A)是上图的动物在第58天(EV治疗组)和第50天(MSC治疗组)处死,搜集胰腺组织和血液,做HE染色,箭头表示胰岛浸润性免疫细胞,在PBS处理的小鼠中剩余的胰岛显示严重的胰岛炎,而MSC衍生的EVs或MSC能抑制胰岛炎和保留胰岛细胞。(图2B)定量检测,分别代表每个载玻片胰腺数、胰岛浸润评分。(图2C)是胰岛炎评分、胰岛素量化,胰岛素在血浆中的表达,通过用EVs或MSC处理我们看到胰岛素血浆水平显着增加。另外和组织学相似,EVs或MSC治疗的小鼠胰岛中CD4 +细胞较少,而在PBS处理的小鼠胰岛存在大量CD4 +细胞(图2D),说明治疗后炎症浸润减少。
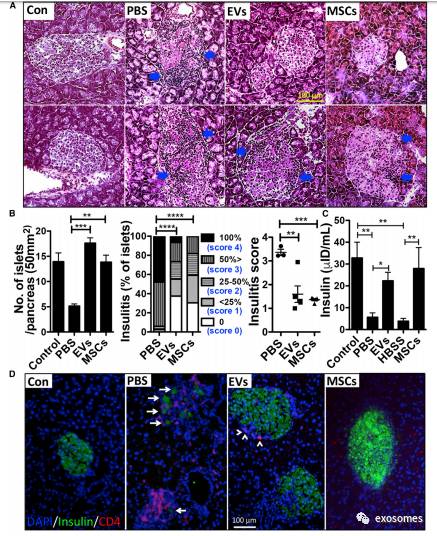
图3:MSC和MSC衍生的EVs阻止小鼠EAU的发展
(图3A)实验方案:在第0天,通过皮下IRBP注射和腹膜内百日咳毒素注射诱导EAU,
诱导后向尾静脉注射MSCs或MSC衍生的EV,PBS做对照。在第21天,收集眼球和引流淋巴结用于测定。
在PBS处理的EAU小鼠视网膜和玻璃体腔中,
第21天视网膜横截面显示视网膜感光体层严重破坏和炎症细胞浸润(图3B),包括CD3 +T细胞出现(图3C),右图分别是视网膜组织学疾病评分和CD3免疫染色定量。通过MSC或MSC衍生的EVs治疗,CD3 +T细胞的数量明显减少,视网膜感光体层存在性好。
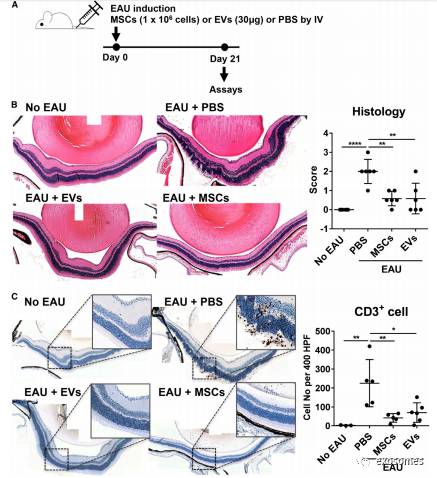
图4:EAU小鼠中MSC衍生的EVs抑制Th1、Th17发育
类似的,在MSC或MSC衍生的EV治疗中的小鼠的眼睛组与PBS治疗对照组相比(图4A),促炎细胞因子的转录水平,干扰素γ(IFN-g),白介素(IL)-17A,IL-2,IL-1b,IL-6和IL-12A明显降低,而IL-4和IL-10的mRNA水平不受治疗的影响。此外,流式细胞术检测显示IFN-g + CD4 +细胞和IL-17 + CD4 +细胞的数量在MSC或MSC衍生的EVs治疗中显着降低(图4B)。这些
数据表明,MSC衍生的EVs同样能有效抑制Th1和Th17细胞发育和功能,并防止EAU疾病进展。
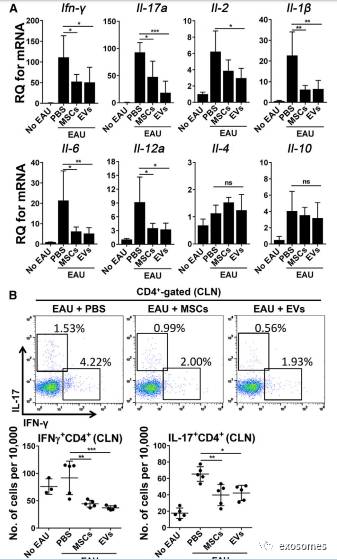
图5:在MLR中MSC衍生的EVs抑制Th1和Th17发育
作者接下来进行了MSC衍生的EVs对免疫细胞活化的影响研究,用同种异体混合淋巴细胞反应(MLR)来测定。在MLR中,MSC衍生的EVs显着降低IFN-g,IL-12p70,IL-6和肿瘤坏死因子α的产生(TNF-α)(图5A),这表明MSC衍生的EVs抑制Th1的发展。而IL-6作为关键因子,能促进下游的IL-17进而介导Th17细胞产生,表明MSC衍生EVs也可以抑制Th17的发展
(图5B)。作者进一步探讨MSC衍生的EVs是否通过抑制Treg调节细胞影响Th1和Th17发育。然而,MLR显示FOXP3+Treg在第6天没有增加(图5C),IL-10,诱导Treg的细胞因子,在MLR的第5天也没有增加(图5D),表明EV通过直接抑制Th1和Th17发育,从而抑制T细胞增殖而不是诱导Treg调节细胞。
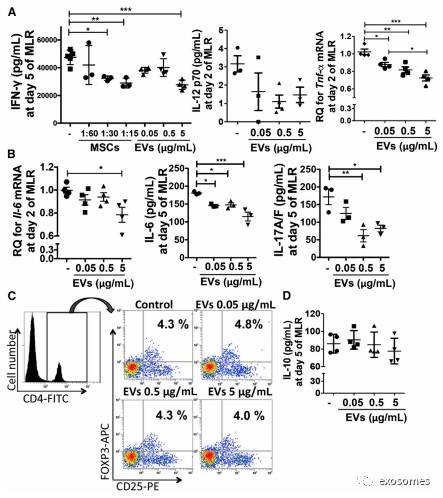
图6:
在MLR中MSC衍生的EVs抑制APC和T细胞激活
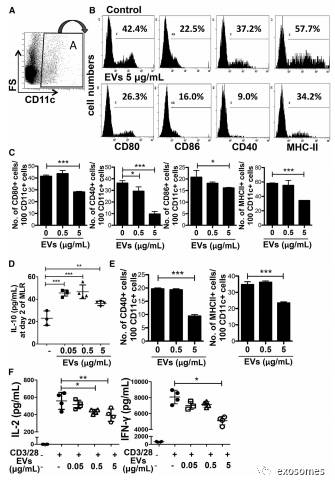
为了研究EV对APC激活的影响,作者在EVs共培养条件下检测共刺激因子(CD80,CD86和CD40)和主要组织相容性复合物(MHC)II类。(图A和B)代表流式细胞术图,(图C)是CD86、CD40、MHC-II型阳性细胞和CD80的定量检测,结果表明,EV和APC
(
CD11c+
细胞)共培养后,抑制共刺激因子和MHC II类的表达。MSC衍生EV治疗显着增加了IL-10的水平在MLR第2天(图6D)。为了探究EVs是否直接抑制APC激活,作者换老鼠重复MLR,如图所示(图6E),EV治疗仍然抑制共刺激因子和CD11c +细胞中的MHC II类的表达。这些数据表明,APC表现出低反应性表型,从而抑制后续T细胞在MLR中的增殖。进一步检查EV是否也直接抑制T细胞活化,从小鼠脾细胞中分离出CD4 + T细胞用CD3 / CD28刺激它们。结果IL-2和IFN-g水平降低,说明EV治疗也抑制T细胞活化(图6F)。