T细胞免疫疗法被广泛认为在不久的将来可以改变血液和顽固恶性肿瘤疾病病人的治疗效果。在嵌合抗原受体(CAR)疗法中,从一位病人体内提取的T细胞通过对基因改造从而成为一个特定癌症抗原的受体,这个数目不断扩展,然后重新注射入病人体内捕获并摧毁癌症细胞。对于这项新技术,业内的看法极其乐观。比如,CAR-T细胞疗法在儿童群体以及患有复发性或难以治疗的急性淋巴性白血病的成年病人群体中的完全康复率高达90%,这在之前是前所未闻的。
CAR-T细胞疗法针对的是那些购买了商业化医疗保险的人群。这种多层次的结构可以被划分成以下群体:
病人,临床医师,医护人员(癌症中心和地区或国家级医护专员)以及医保支付方(公共和私人保险公司)T细胞疗法被期望能够成为一种先端机制,通过一连串的事项帮助保险公司决定是否要为一种CAR-T细胞疗法埋单。保险支付方将实际地决定是否医护人员能够让临床医师对病人使用这种疗法。
药物(小分子药)以及治疗癌症的单克隆抗体商业化开发的思路都主要集中在产品的销售环节上(比如丸剂或输液剂),通过相关有限的额外协助(产品支持的形式),从而使所需群体得到它们。一种基础思路的转变体现在:什么样的特定需求应该提供或者销售给所需群体。如果CAR-T细胞疗法的商业潜能能够被全部释放展现出来,那么它的监管批准将变的非常重要,但不一定足够能确保商业开发的成功。商业开发人员对购买人群提供了怎样的建议,将决定由T细胞疗法所带来的经济层面的回报,除此之外还有产品本身。
当考量这个产品概念的相对提议时,就面临这两个关键问题。第一个是:相对与药品或生物制品的生产商,为什么必须要商业开发人员为患者提供一种易于理解的课程协助或服务呢?从药物到重组蛋白再到单克隆抗体以及最终到细胞疗法,其治疗成分的规模和复杂程度因每一步都涉及大量的指令而不断上升。这就意味着CAR-T细胞疗法是高度复杂的药品,并且在生产,供应链,商业模型,医保支付和临床采纳这些问题上,做到商业化都有着不小的难度。因此所需要的支撑就要由商业开发人员提供,以确保患者最终能够使用这种治疗方法。
第二个问题是:CAR-T细胞疗法的自体同源(从病人体内获取)与异源体(非自身获得,从捐赠者体内获取)都要求提供有着近似宽度和深度的来源方案呢?考虑到自体同源疗法与当下医疗领域所提供的方案有着很大的不同之处,他们就需要从商业开发的层面上获得极大的支撑。异源疗法因为进入医院的渠道障碍较低因此所需的担保方案相对就少一些,这是因为他们和现行药物以及生物药有着许多相似的地方,大多数重要的商业化进程都采用现货供应的方式,也就是说一种治疗方法会先行开展,并随时可用。自体同源疗法会通过服务型模式,这是指对于个体病人展开特定的治疗。商业模式(现货供应VS服务型模式)会带来大量的衍生性结果,具体这些结果取决于给予了患者多少需求上的支持,这其中就需要考虑到其他重要的商业化环节诸如生产和供应链管理,医保支付和临床采纳。
这里还要展示一种新的架构模式(构建-产品-方案框架模式)用以保住商业开发人员聚焦应该把什么样的CAR-T细胞疗法特定需求提供/销售给所需群体。尽管本文是重点关注CAR-T细胞疗法的,不过这个框架结构同样于其他基于治疗癌症的细胞免疫疗法有关联,比如T细胞受体,T细胞基因改造疗法等。
在实际被提供/销售给患者的过程中,CAR-T细胞疗法需要考虑三个层面的内容 1 构建(比如所用的CAR-T细胞疗法的特性是什么)2 产品(FDA或欧洲药管局实际批准了什么)以及3 提议方案(商业开发人员应该在产品批准上市之后提供给患者那些范围内的服务/支持)。构建-产品-方案结构展现在图1 中并在下方对细节部分展开了讨论。方案的设计应该与临床开发保持同步,这样在产品批准/立项开始的时候,商业开发人员就可以给患者提供建议方案了。
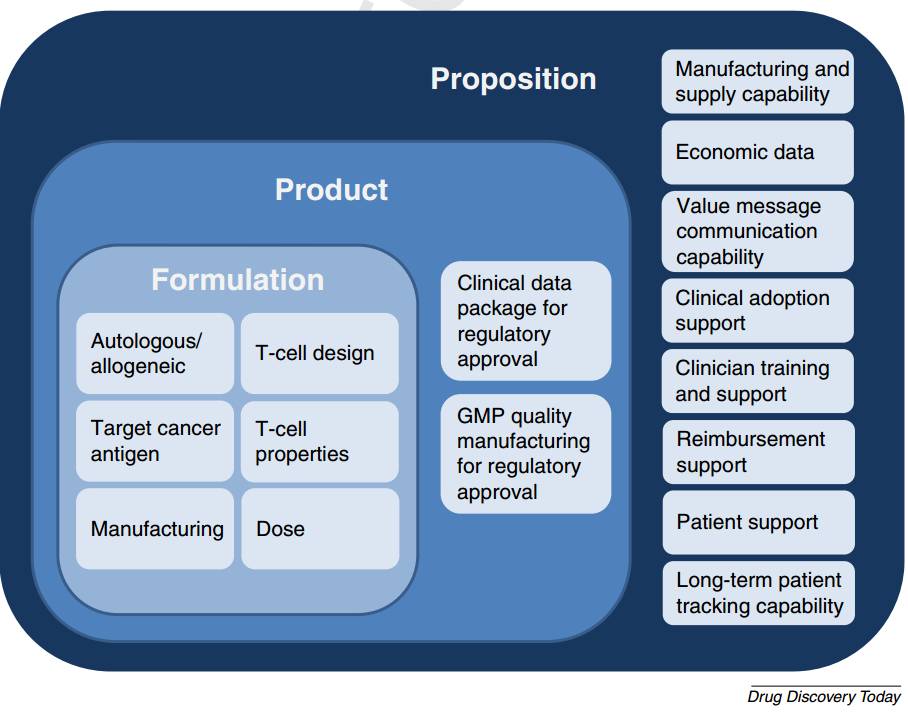
具有功能的CAR-T细胞疗法的构建应该包含以下六个方面因素
1.
自体同源(病人体内获取)或异源(从捐赠者体内获得)
:两种方法目前都有机构进行开发研究,例如宾大/诺华制药,朱诺制药/新基制药,以及凯特制药/美国安进正在研究自体同源疗法,同时辉瑞和Cellectis,以及默克雪莱诺与Intrexon在研究异源疗法。
2. T
细胞的设计
:一个嵌合抗原受体是由一个细胞外抗体控制域所构成的,它缠绕住一个互补癌抗原。这个抗体区域由铰链中枢和跨膜细胞域连接到细胞内信号控制域,细胞内信号控制区域是用来进行抗肿瘤活动,T细胞存活以及T细胞增生。
3.
目标癌细胞抗原
:现如今,临床研究中的CAR-T细胞已经主要针对CD19,它在健康性和恶性B细胞中都被发现过,更为重要的是其他地方没有发现过。淋巴瘤和B细胞源白血病使用过抗CD19型CAR疗法,T细胞已经展现出优异的反应表现,更重要的是病人可以在没有 B细胞的情况下存活,它们同样被抗CD19型CAR-T细胞所消灭了,只要他们接受过免疫球蛋白替代性疗法的治疗。此时,顽固癌细胞对于CAR-T细胞而言是个更加难对付的目标,(但CAR-T细胞)会如同无明显抗原那样显著地只显示顽固癌细胞而不会显示健康细胞。
4. T
细胞属性
:
CAR-T细胞的安全性和疗效如同他们的细胞扩张能力以及在给病人注射之后的长期持久性能力一样是极其重要的。
5.
生产
:所进行的一项CAR-T细胞疗法产品的生产进程是一项基础性工作,决定了其最终的成品。并且包含了从病人体内的提取T细胞,为一个特定的CAR细胞转移到T细胞中去的载体介导基因,病人身上的T细胞经过修饰之后的扩张,冷冻保存以及给病人的输液。
6.
剂量
:CAR-T细胞的剂量和注射计划必须平衡疗效和安全性。
产品应该是按照基于临床数据进行的构建进行生产并且其生产计划需要得到来自FDA或欧洲药管局的批准。
1 临床数据包:
这里面是有关安全和疗效性数据,能够让监管方同意给予其市场准入授权。
2 良好生产工艺规范:
生产进程质量,建立一个GMP生产工艺程序是获得监管批准的要项,并且它将被用于产品最终的商业化。
在获得监管批准之后,一种细胞疗法产品想要获得满意的经济回报的话,来自商业开发人员的方案必须可行。以下八个领域被认为是方案环节种的关键。
如今小分子和治疗癌症单克隆抗体药物的商业化已经采用现货供应的模式了,这种模式也将被异源CAR-T细胞疗法所使用。尽管这还需要对由于产品保存期,稳定性以及运输这几个部分的问题而做改良。换句话说,自体同源CAR-T细胞疗法将会通过基于服务的模式而实现商业化,也就意味着必须有一个通道机制,供临床医师从病人身上获得T细胞然后再将他们转入到疗法产品的生产设备中,接下来再由CAR-T细胞疗法产品重新通过注射到病人体内。必须有能力确保这个全部进程的效率,成本控制以及做到无差错。
经济数据:
药物经济学数据在临床开发阶段就被要求进行收集,同样要通过健康经济学模型来确认CAR-T细胞疗法的成本控制能力,以及对于医保支付方的预算影响。这项数据是由健康医护技术评测所规定要求收集的。用来评测一种药物是否值得报销。一种疗效方法宣称可以使(病人)长期受益,比如可以使一位儿童病人存活到其进入成年,那这种听起来具有争议性的宣传就需要在其已有的临床数据和其所宣称的长期效果之间建立一个至少听上去可行的联系机制。
价值信息沟通能力:
考虑到使用CAR-T细胞癌症疗法的人均费用高达500000 美金,这就要面对大量来自医保支付方的审查。因此商业开发必须具有能力保证最合适的有效价值沟通,从而获得满意的报销水平。这项工作就要求和医疗技术评测机构,能够拍板作出报销决定的医护人员和临床医师,或者在国家,地区或当地行政机构能够左右一项疗法所涉及复杂报销问题的专家委员会保持紧密联系。
临床采纳支持:
考虑到CAR-T细胞疗法代表着一种新的治疗模式,争论点就出现在该如何最好的将他们与现行医保体系相融合,因此就需要向癌症中心提供支持确保CAR-T细胞疗法尽可能容易的走医保/病人自己的支付通道。自体同源疗法如果采用基于服务型的商业模式就会特别地面对高难度的临床采纳问题。
临床医师培训及支持:
必须给那些能够开处方以及给病人注射疗法产品的临床医师提供培训和项目进行中的支持。
医保报销支持:
一旦一种CAR-T细胞疗法能够报销,临床医师和癌症中心可能需要一些支持,来正确且有效的告知公共或私人医疗保险机构为病人的注射治疗埋单。这在有着复杂医保报销系统的国家中,以及在生产商和支付方之间存在复杂风险分担的情况下就显得尤为重要。
病人支持:
对于注射前和注射后的癌症病人,支持和信息条款必须要准备完善。
长期跟踪观察的病人情况能力:
在病人得到批准注册使用疗法之后将需要具备一项功能,那就是跟踪观察病人病情,收集上市之后有关长期安全性和有效性方面的数据。这项长期数据将会被医保支付方用以讨论继续报销的问题。
一种对于T细胞癌症疗法的商业化的新框架理论已经被提供给商业开发人员。在关于他们到底应该给客户提供什么的这个问题上用一种结构性的方法最大化的实现商业上的成功。这种框架是基于CAR-T细胞的构建,产品和方案这些部分。产品要结合能够获得监管批准的数据而设计的构建生产。然后获得市场准入授权并不是自动意味着接下来就会获得商业层面的成功。产生满意的利润依赖于能够获得可接受的医保报销能力以及临床采纳。很大程度上,这些因素都共同依赖于商业开发人员提供出来的方案(比如支持方案)的宽度和深度。实际上,在一个多种CAR-T细胞疗法都为了相似适应症指标而进行开发的环境中,可想而知可能只是证明方案与其产品本身一样,在产生高经济回报的层面上很重要。
参考文献:
Malik NN, Durdy MB. CAR T-cell therapies: formulation-product-proposition framework for commercialisation.Drug Discov Today. 2016 Nov;21(11):1731-1734.
识别微信二维码,添加生物制品圈小编,符合条件者即可加入生物制品圈微信群!















