正文
肿瘤干细胞(CSC)及其诊疗意义是肿瘤研究的重要前沿领域和进展。越来越多的证据表明,CSC是肿瘤发生、转移和复发的关键细胞。CSC如何产生和维持?肿瘤内免疫细胞为何不能有效阻抑CSC的恶性行为?围绕CSC(“种子”)与免疫微环境(“土壤”)的相互作用和治疗学意义这一科学问题,第三军医大学西南医院全军临床病理学研究所卞修武教授带领“肿瘤干细胞研究”国家重点领域创新团队,从1997年开始在国家自然科学基金、973和863计划等项目资助下,开展了系列而深入的研究。他们不仅揭示了CSC在肿瘤微环境血管生成中的作用机制及其诊疗意义(2012年国家科技进步一等奖内容之一),而且发现免疫细胞和因子对CSC的诱导与调控作用以及CSC逃逸免疫而发生转移的机制(J Immunol 2012, 189: 444-53; Cancer Res 2014, 74: 5746-57),拓展了肿瘤免疫微环境研究新领域,提出靶向CSC免疫微环境的治疗新策略(Cell Stem Cell 2015, 16: 219-20)。
近日,该团队在《自然》子刊Nature Communications发表最新研究进展。他们通过分析胶质母细胞瘤(一种最常见的脑原发性恶性肿瘤)瘤组织中M2型肿瘤相关巨噬细胞(TAM),发现这些巨噬细胞可以大量分泌一种叫做pleiotrophin(PTN)的蛋白,而胶质母细胞瘤的CSC存在大量它的受体PTPRZ1,二者结合能激活一系列信号通路,产生CSC并维持其恶性行为,促进肿瘤生长和进展,导致患者死亡率增高;特异性阻断PTN/PTPRZ1相应通路,可以有效达到治疗效果。这一发现揭示了TAM旁分泌所形成的特殊免疫微环境对CSC始动胶质瘤恶性行为的促进作用,并建立了针对CSC与TAM相互作用的新型靶向治疗策略。上述论文第一作者单位是第三军医大学全军临床病理学研究所,第一作者时雨,通讯作者卞修武;美国克利夫兰医学中心的鲍仕登(Shideng Bao)是共同通讯作者(全军临床病理学研究所客座教授,课题组成员)。全文链接:https://www.nature.com/articles/ncomms15080。
文中使用的部分RNA干扰慢病毒由和元上海提供。


1. M2 TAMs高表达PTN,且PTN高表达提示胶质母细胞瘤(GBM)患者预后不佳
为了筛选胶质瘤中M2 TAM源性的分泌蛋白,作者通过流式分选,从6例人GBM样本中分离了M2 TAM (CD11b+/CD163+) 和对照TAM (CD11b+/CD163-)(图1a-b)。通过芯片聚类分析和qRT-PCR,作者发现相对于对照组TAM,PTN(Pleiotrophin)在6例原代M2 TAM中显著高表达(图1c-d)。免疫荧光检测结果提示,人GBM样本中PTN表达与TAM标记物Iba1和M2 TAM标记物CD163存在共定位(图1e-h)。利用癌症基因组数据库(TCGA database)进行进一步分析,发现PTN高表达提示GBM患者预后不良(图1i-l)。
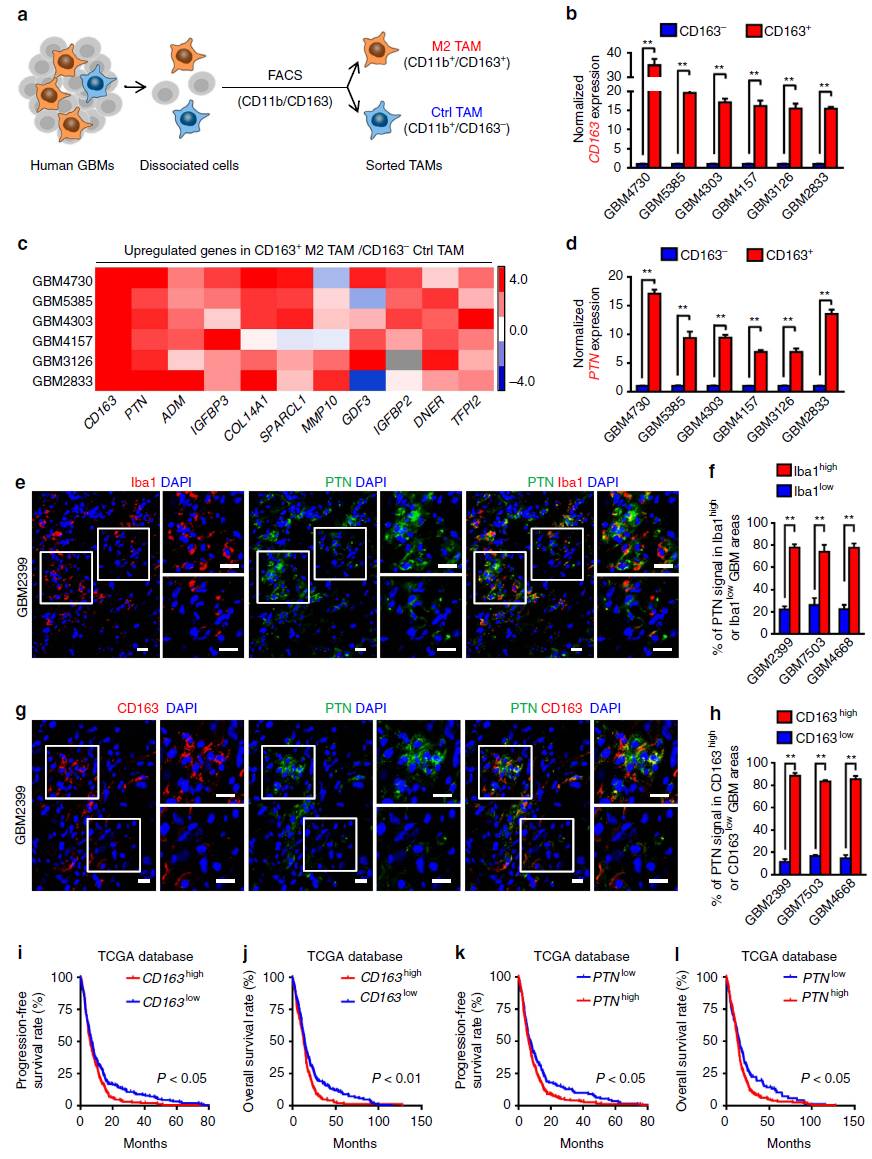
图1 M2型TAMs高表达PTN,而PTN高表达患者预后差,生存期短
2. PTN是GSCs微环境中的重要成分,且介导M2型TAMs对GSC肿瘤生长的促进作用
通过免疫组织化学染色,作者发现M2 TAM(通过标记物CD163表征)高表达PTN且与GSC(通过标记物SOX2表征)存在共分布(图2a-b),提示PTN是GSCs微环境中的重要成分。为进一步检验PTN对GSC始动的肿瘤生长的作用,作者构建巨噬细胞与GSC共注射的移植瘤模型(图2d),发现干扰PTN表达能显著抑制巨噬细胞对GSC肿瘤生长的促进效应(图2e-g)。
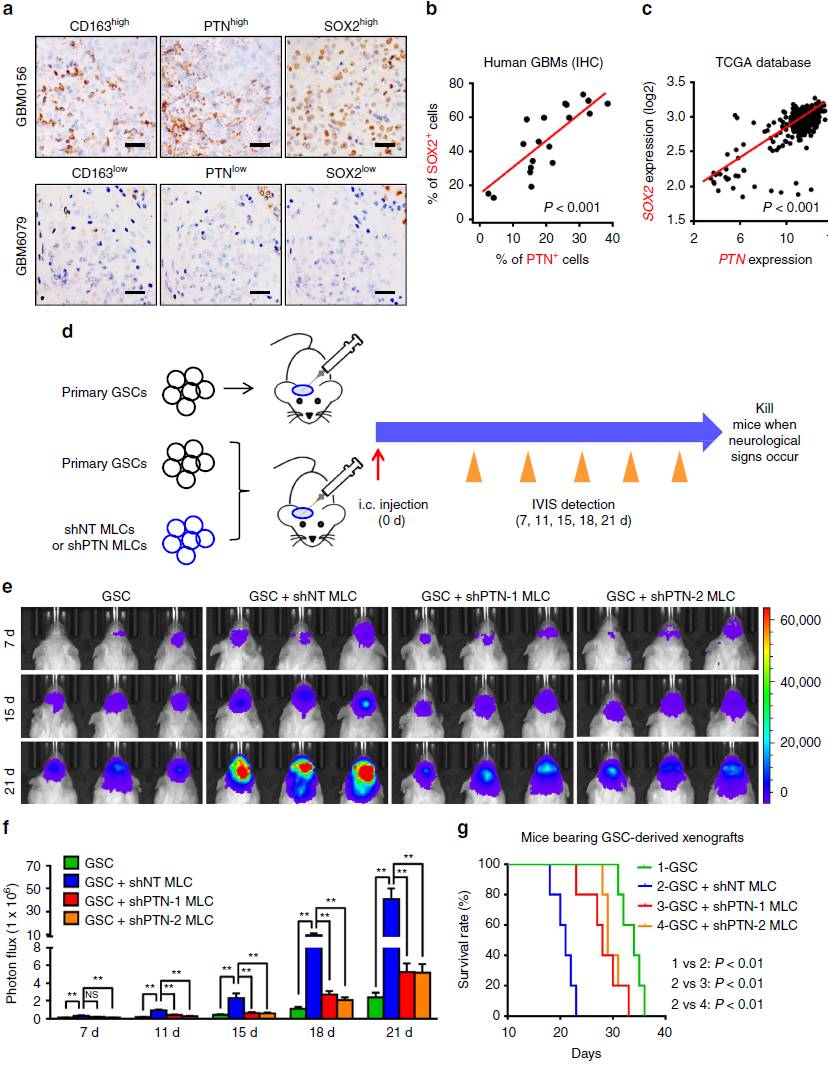
图2 PTN是GSC肿瘤免疫微环境的重要成分且介导M2 TAMs对肿瘤生长的促进作用
3. PTN的受体PTPRZ1在GSC高表达
既然PTN与肿瘤生长相关,那么PTN通过哪条通路产生这种作用呢?接下来作者研究了PTN的受体PTPRZ1的表达,发现胶质母细胞瘤样本中PTN与PTPRZ1显著正相关(图3a)。作者进一步发现,PTPRZ1在GSC中显著高表达(图3b-d),且与GSC标记物SOX2、Olig2、CD133存在共表达(图3e-j)。
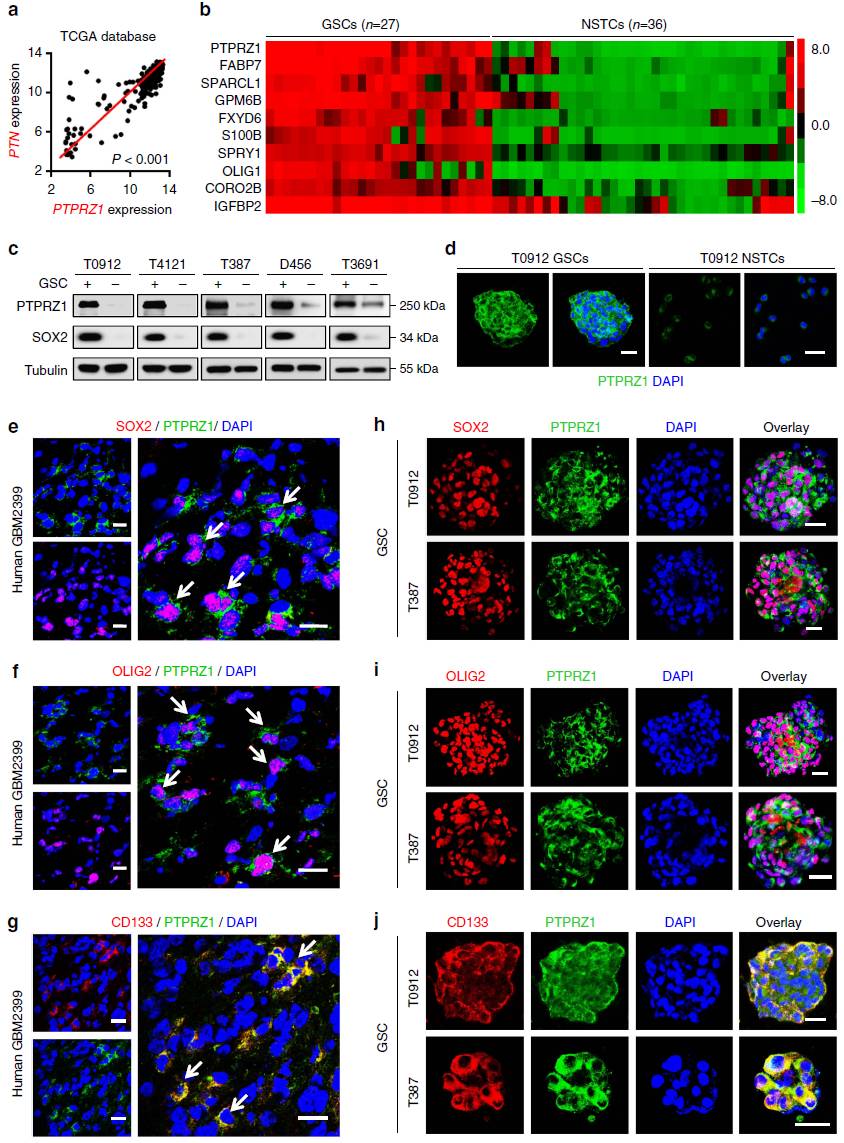
图3 PTN的受体PTPRZ1在GSC高表达
4. PTN-PTPRZ1信号通路促进GSC干性表型
为了明确PTN/PTPRZ1通路对GSC干性表型的影响,作者通过细胞增殖实验和极限稀释实验,发现重组PTN活化能促进GSC增殖和自我更新能力(图4a-b)。同时,干扰PTPRZ1表达能够抑制PTN对GSC增殖、自我更新和成球能力的促进作用(图4c-d)。
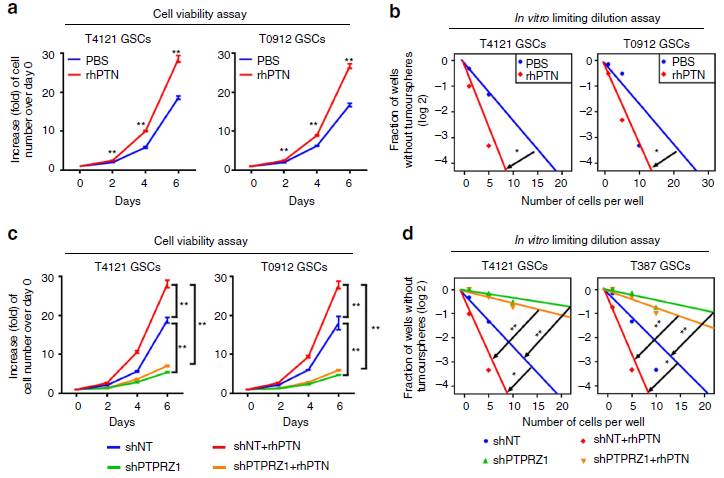
图4 PTN-PTPRZ1信号对于GSC的维持非常关键
5. 干扰PTPRZ1信号会抑制GSC肿瘤生长
而动物实验表明,如果干扰PTPRZ1的表达,GSC肿瘤生长则会得到明显抑制,且动物的预后存活明显提高(图5),提示PTPRZ1是抑制GSC肿瘤生长的潜在治疗靶点。
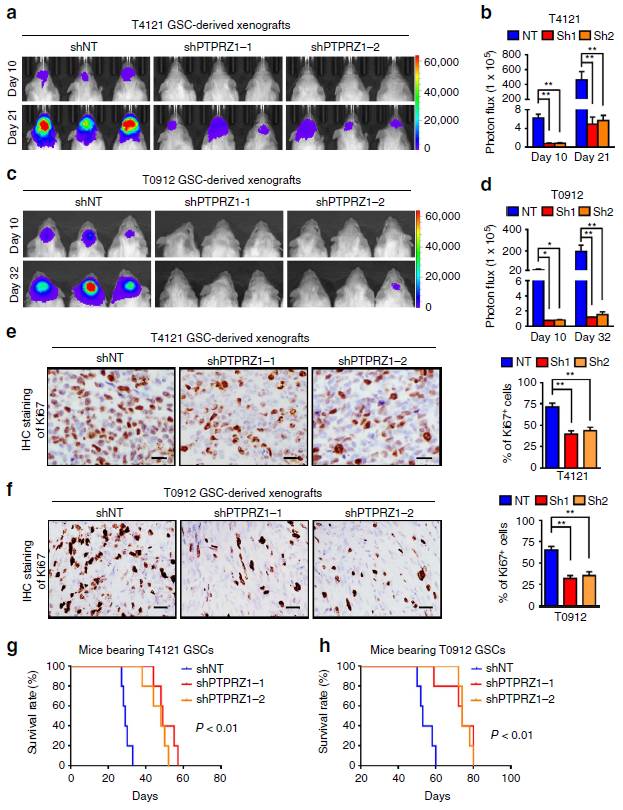
图5 干扰PTPRZ1信号会抑制GSC肿瘤生长
6. GSC与PTPRZ1密切联系
前文我们看到PTPRZ1对于GSC的维持和肿瘤生长重要,那么PTPRZ1能否作为GSC的新标志物呢?作者通过分离并比较PTPRZ1阳性和PTPRZ1阴性的胶质瘤细胞亚群(图6a-b),发现PTPRZ1阳性胶质瘤细胞高表达GSC标记物CD133、SOX2(图6c)且具有更强的成瘤能力(图6d-g)。此外,PTPRZ1表达随GSC分化而逐渐下降,提示PTPRZ1表达与GSC表型密切相关(图6h)。
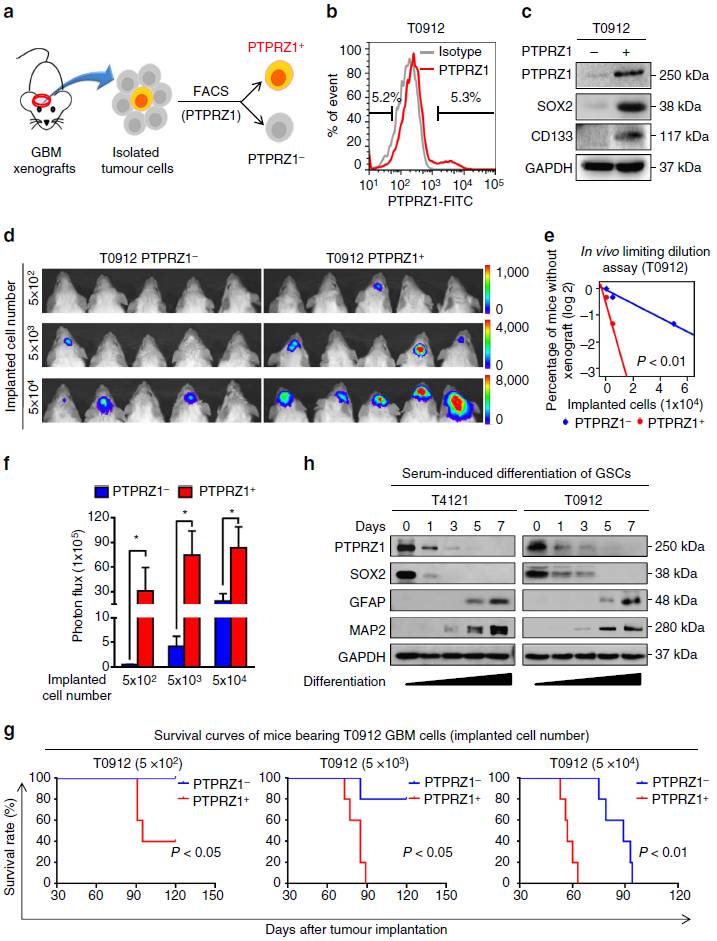
图6 GSC富集于高表达PTPRZ1的胶质母细胞瘤细胞中
7. 阻断PTN-PTPRZ1通路能够有效抑制GSC肿瘤生长并延长荷瘤鼠生存期
作者最后探索了阻断PTN-PTPRZ1通路的潜在治疗意义,发现抗PTPRZ1抗体处理能显著抑制GSC始动的GBM肿瘤生长并延长动物的生存时间(图7)。

图7 阻断PTN-PTPRZ1通路有效抑制GSC肿瘤生长、延长动物寿命
本文揭示了TAM旁分泌所形成的特殊免疫微环境对GSC始动胶质瘤恶性行为的促进作用,并建立了针对GSC与TAM相互作用的新型靶向治疗策略,推进我们对胶质母细胞瘤免疫微环境的认识。















