
我国于1949年11月由卫生部牵头召集在京有关医药专家研讨编纂药典问题,第一部《中国药典》1953年版由卫生部编印发行。历经几十年的发展历程,《中国药品》不断修订和完善,收载品种尽可能做到统一协调、求同存异。
2015年版《药典》是新中国成立以来的第10版药典。2015年版《药典》收载品种总数达到5608个,比2010年版药典新增1082个。涵盖了基本药物、医疗保险目录品种和临床常用药品,更加适合于临床用药的需求。
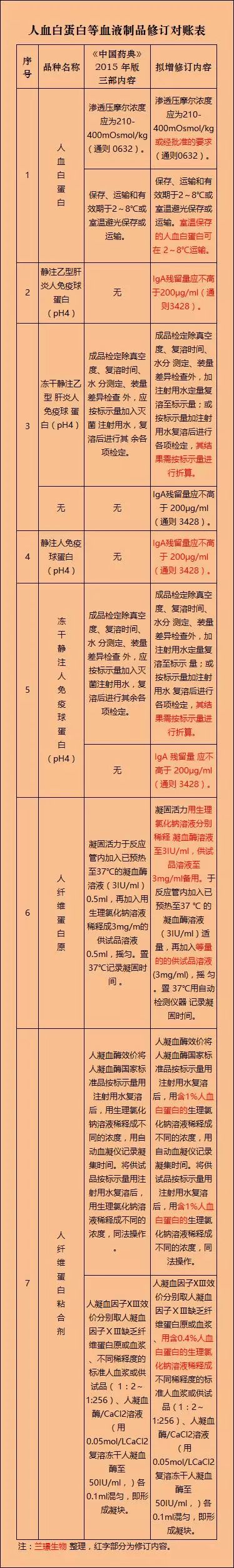
兰璟生物 关注到日前国家药典委员会拟对《中国药典》2015年版(三部)血液制品相关内容进行增修订,我们节选人血白蛋白等血液制品部分的拟增修订内容(见附件),按照国家药典委员会要求,各血液制品企业须于2018年1月31日前将反馈意见进行提交。
关于《中国药典》2015年版(三部)
血液制品拟增修订内容的公示
各有关单位:
经国家药典委员会血液制品专业委员会审议,拟对《中国药典》2015年版(三部)血液制品相关内容进行增修订,现将拟增修订内容(见附件)进行公示,请于2018年1月31日前将反馈意见发至我委。
联系人:曹琰
联系方式:010-67079595
E-mail:[email protected]
国家药典委员会
2017年11月1日
《中国药典》2015年版(三部)血液制品拟增修订内容
本法用于测定人免疫球蛋白类制品中IgA残留量,包括紫外-可见分光光度法、酶联免疫法和散射比浊法。首次采用本法检测供试品中IgA残留量时,应根据不同样品基质及IgA残留量的水平选择适宜的测定方法并做相应方法学验证。紫外-可见分光光度法和酶联免疫法中IgA残留量的效价单位可根据标准品标签说明换算成质量单位。
第一法 紫外-可见分光光度法(仲裁法)
本法系依据免疫球蛋白A(IgA)与相应的抗体特异性结合后,在适宜的电解质、温度、pH条件下,产生凝集反应,形成抗原-抗体复合物,用比浊法测定供试品中IgA的残留量。
试剂(1)缓冲液称取三羟甲基氨基甲烷(Tris)12.42g、氯化钠9g、聚乙二醇600050g、牛血淸白蛋白(BSA)lg、叠氮化钠(NaN3)lg,加水适量使溶解,用lmol/L盐酸溶液调节pH值至7.4,用水稀释至1000ml。如缓冲液中不添加叠氮化钠,应临用新制
(2)抗人IgA血清取抗人IgA血清(应为全血清经过一定纯化技术分离制得的特异性抗体)适量,加缓冲液稀释至抗体最终效价为1:4(例如抗人IgA血清效价为1:100,量取原液2ml加抗体缓冲液48ml),充分混匀,0.45μm滤膜滤过,作为工作抗体液,4°C保存备用。
IgA标准品溶液的制备按IgA标准品使用说明书加水复溶,精密量取适量,用0.9%氯化钠溶液定量稀释制成每1ml中含IgA25IU、12.5IU、6.25IU、3.125IU、1.5625IU的溶液。
供试品溶液的制备 取供试品原液或将供试品用0.9%氯化钠溶液定量稀释制成适当浓度,作为供试品溶液,使其IgA残留量在标准曲线范围内。
测定法 分别取IgA标准品溶液和供试品溶液各10μl,加入已预热至37℃的工作抗体液lml,混匀,平行做2管,置37℃水浴中保温1小时,放冷,充分混匀,照紫外-可见分光光度法(通则0401),立即在波长340nm处分别测定吸光度(全部反应管自水浴中取出后必须在10分钟内测量完毕)。同时以0.9%氯化钠溶液10μl替代供试品溶液,同法操作,作为空白对照。
计算标准品和供试品溶液吸光度的均值。以标准品溶液IgA含量的对数对其相应的吸光度的对数作直线回归,求得直线回归方程,相关系数应不低于0.99;将供试品溶液吸光度的对数值代入直线回归方程,求得值的反对数,再乘以稀释倍数,即得供试品中IgA残留量。
第二法 酶联免疫法
本法系采用酶联免疫法测定供试品中IgA残留量。
试剂 按经验证的人IgA酶联免疫试剂盒说明书配制试剂。
标准品溶液的制备 取IgA标准品,加适量水复溶,用试剂盒中稀释液将复溶后标准品在每1ml含0.625×10-3~10×10-3IU范围内做适当的系列稀释(通常做5个稀释度)。
供试品溶液的制备 取供试品适量,用试剂盒中稀释液定量稀释制成适当浓度,使其IgA含量在标准曲线范围内。
测定法 按试剂盒说明书进行,分别设置1孔底物空白对照和稀释液对照,标准品溶液及供试品溶液均做双孔平行测定。试剂盒底物空白对照和稀释液对照的吸光度应在试剂盒要求范围内,试验有效。以标准品溶液的IgA含量的对数对其相应的吸光度的对数作直线回归,求得直线回归方程,相关系数应不低于0.99;将供试品溶液的吸光度代入直线回归方程,求得值的反对数,再乘以稀释倍数,即得供试品中IgA含量。
【附注】(1)本法测定范围为0.4×10-3~25×10-3IU/ml,每次测定可根据供试品中IgA含量,在测定范围内适当调整标准品溶液浓度。当标准品溶液配制浓度较高时,建议数据拟合模型选择半对数回归,即以标准品溶液的IgA含量的对数对其相应的吸光度作直线回归。
(2)试剂盒的验证应至少包括线性、回收率试验和精密度试验等内容。线性回归的相关系数应不低于0.99;高、中、低浓度样品的平均回收率应在80%~120%;试剂盒批内相对标准偏差(RSD)不得过10%,批间相对标准偏差(RSD)不得过15%。
第三法 散射比浊法
本法系依据免疫球蛋白A(IgA)与包被着IgA特异性抗体的颗粒混合时,包被着抗体的颗粒会发生聚集。这些聚集体会使穿过供试品的光束发生散射,散射光的强度与供试品中IgA浓度成正比,与已知的IgA定标品浓度对比即可求出供试品中IgA含量。
本法主要采用经批准的全自动蛋白分析仪及仪器自带的试剂盒对供试品中IgA残留量进行测定。仪器自带的试剂盒通常包括IgA定标品、质控品、IgA抗体试剂及辅助试剂等。
试剂、IgA定标品和质控品溶液的制备 按试剂盒说明书操作。
供试品溶液的制备 取供试品适量,用稀释液稀释至每1L中约含IgA1mg的溶液,上机后不再进行稀释,直接测定。
测定法 按仪器使用说明书进行,供试品应平行测定双份。试剂盒标准曲线的拟合偏差和质控品测定值应在试剂盒要求范围内,试验有效。记录供试品溶液的报告值,再乘以稀释倍数,即得供试品中IgA残留量。
【附注】供试品溶液也可以采用全自动蛋白分析仪自动稀释至要求的浓度,报告值即为供试品中IgA残留量。

本文由 兰璟生物 整理报道
内容来源:CFDA
原标题:关于《中国药典》2015年版(三部)血液制品拟增修订内容的公示
















