蛋白酪氨酸磷酸酶SHP2由
PTPN11
基因编码,是第一个被报道的含有SH2 结构域的磷酸酶。SHP2包含两个SH2结构域和一个PTP结构域
[1]
。在基础状态下,SH2 结构域结合在PTP 结构域上,形成闭口构象,SHP2处于自抑制状态。当SH2 结构域与PTP 结构域解离,暴露PTP上的活性位点时,SHP2形成开口构象,转入激活状态(图1)。
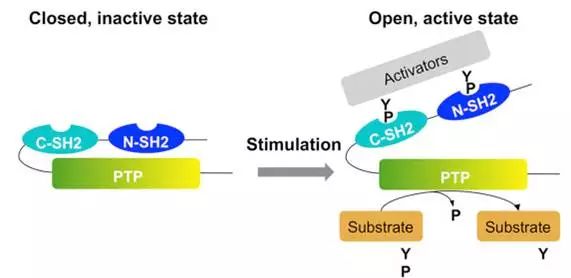
图1. SHP2构象与活性的关系
SHP2
广泛表达于各种组织与细胞,参与调控细胞内多条重要信号通路如RAS-ERK
、
PI3K-AKT
、
JAK-STAT
、
NF-κB等,因此在细胞的分化、存活、增殖、迁移等活动中扮演着重要的作用。
目前的研究表明SHP2介导肿瘤发生的机制主要包括:1、作为致癌基因,SHP2可介导激活RAS-ERK信号通路促进癌细胞的存活和增殖
[2,3]
;同时,SHP2还介导了MEK等激酶被抑制之后的代偿性激活途径,从而促进肿瘤耐药的发生
[4-6]
;2、作为PD-1受体的下游分子,SHP2还参与T细胞抑制性信号的传导(图2)。
因此,靶向SHP2可恢复或增强T细胞介导的抗肿瘤免疫功能。

图2. SHP2参与的信号通路
[7]
《药学学报》中英文两刊青年编委、南京大学医药生物技术国家重点实验室孙洋教授团队
以SHP2变构抑制剂SHP099
[8]
为工具分子,初步探讨了靶向SHP2在肿瘤免疫治疗中的作用。该研究发现在不直接杀伤肿瘤细胞的情况下,小分子SHP099一方面可通过恢复(
Normalization
)受抑制的T细胞通路,另一方面亦可增强(
Enhancement
)CD8
+
细胞毒性T细胞介导的抗肿瘤免疫来降低肿瘤负荷
(图3)。
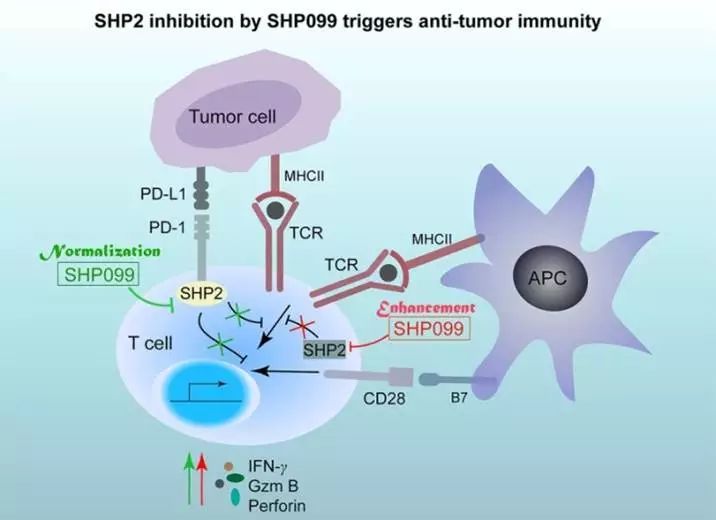 图3. SHP2抑制可增强抗肿瘤免疫
图3. SHP2抑制可增强抗肿瘤免疫
鉴于SHP2这种致癌样作用,针对SHP2抑制剂的开发可谓恒河沙数。但是,
早期开发的抑制SHP2极性活性位点的带负电荷的化合物,口服用药时很难有效地跨越细胞膜或进入血液循环,因此这些SHP2抑制剂的疗效差强人意,甚至没有一例能够进入临床试验阶段。2016年,诺华的研究人员巧妙地使用了一种变构抑制的策略,筛选得到一种名为SHP099的小分子,可结合于SHP2的三个结构域的交界处,利用分子间氢键作用将SHP2“粘”在闭口构象,维持自抑制状态,从而抑制SHP2的活性(图4)。
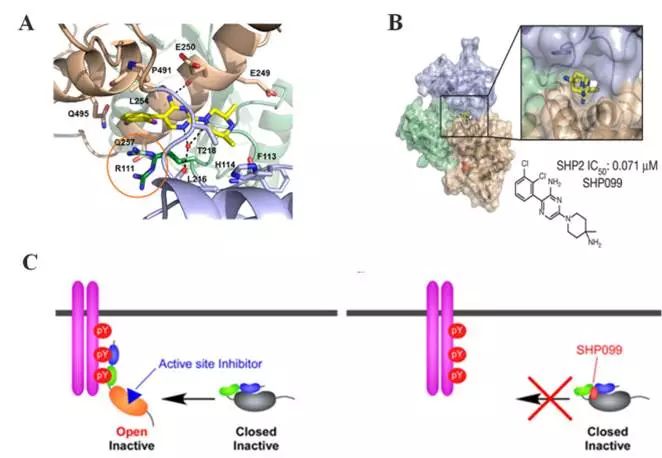 图4. 诺华报道的首个SHP2变构抑制剂
[7,8]
图4. 诺华报道的首个SHP2变构抑制剂
[7,8]
诺华的研究人员发现,灌胃给予100 mg/kg的SHP2抑制剂SHP099可显著抑制裸鼠移植瘤的生长,这种抑制效应是通过抑制肿瘤增殖来实现的。
那么除了抑制肿瘤生长,SHP099是否还存在不依赖细胞增殖信号的抗肿瘤效应呢?
为了回答这个问题,孙洋教授研究团队巧妙地使用了体外对SHP099不敏感的鼠源结肠癌细胞株CT-26,SHP099在高达10 µM浓度作用72h仍不直接杀伤该细胞(图5)。
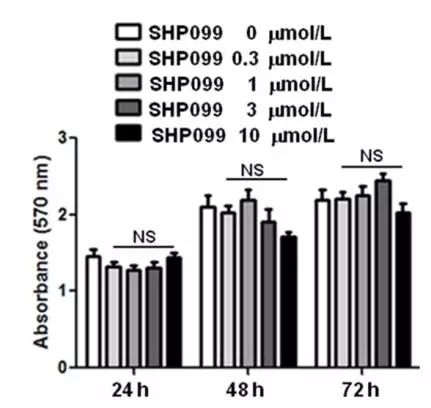
图5. SHP099体外不直接杀伤CT-26结肠癌细胞
接下来,该研究团队观察到
一个
比较有趣的现象
:在免疫系统健全的BALB/c小鼠移植瘤模型上SHP099可显著抑制肿瘤的生长(图6A, B),而在T细胞缺陷的裸鼠模型上,SHP099则失去了对移植瘤的抑制作用(图6C, D)。这一结果提示SHP2抑制剂SHP099发挥抗肿瘤效应依赖于T细胞介导的免疫反应。
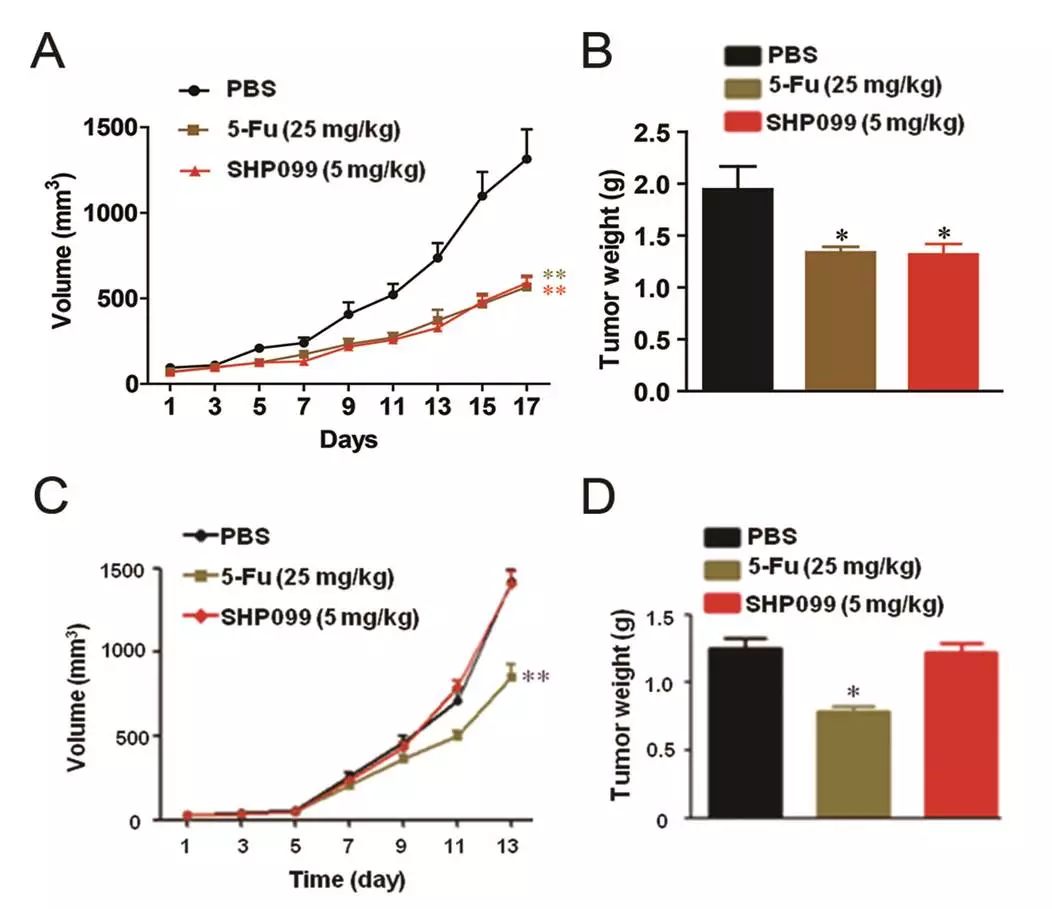 图6. SHP099发挥抗肿瘤效应依赖于T细胞
图6. SHP099发挥抗肿瘤效应依赖于T细胞
进一步通过检测小鼠肿瘤内CTL相关蛋白以及基因的表达水平,验证了SHP2抑制剂可显著促进肿瘤内CD8
+
T细胞分泌肿瘤杀伤因子IFN-γ及GzmB(图7)。
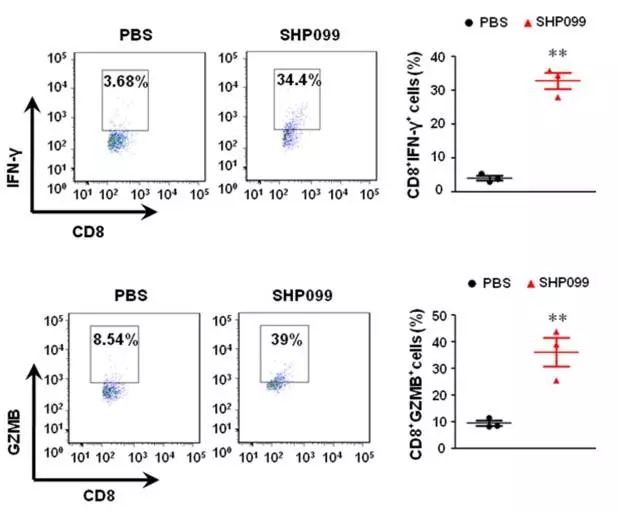 图7. SHP099可增强CTL细胞功能
图7. SHP099可增强CTL细胞功能
该研究团队
前期研究表明,T淋巴细胞上敲除SHP2可引发抗肿瘤免疫,抑制小鼠结肠炎相关癌症的发生
[9]
。因而猜测T细胞可能是SHP2抑制剂作用的靶细胞。为了验证这一猜测,研究人员在T细胞上条件性敲除SHP2的小鼠上开展皮下移植结肠癌细胞MC-38的荷瘤模型。结果显示,条件性敲除组小鼠的肿瘤明显被抑制(图8),且这种抑制效应亦是通过增强CTL介导的抗肿瘤免疫来实现的。
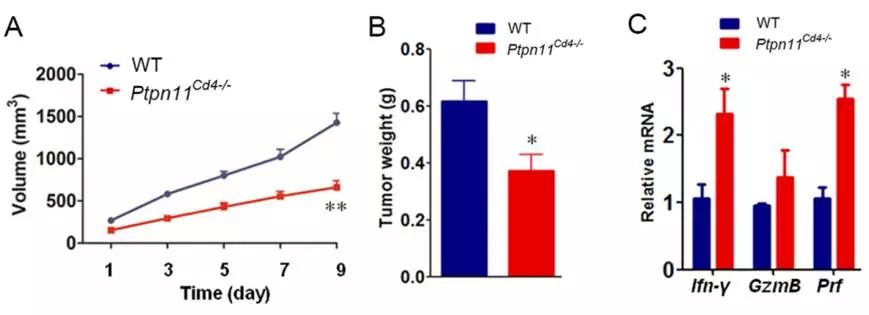 图8.
条件性敲除T细胞SHP2可抑制肿瘤生长
图8.
条件性敲除T细胞SHP2可抑制肿瘤生长
已有研究表明,SHP2是PD-1信号传导的下游分子,它不仅抑制T细胞活化而且促进T细胞的失能
[10-12]
。因而,研究人员又考察了SHP099与anti-PD-1抗体联用效果。结果显示,SHP099与anti-PD-1抗体联用,阻断T细胞抑制性信号的两个不同环节,在治疗小鼠结肠癌中具有明显的协同作用(图9)。
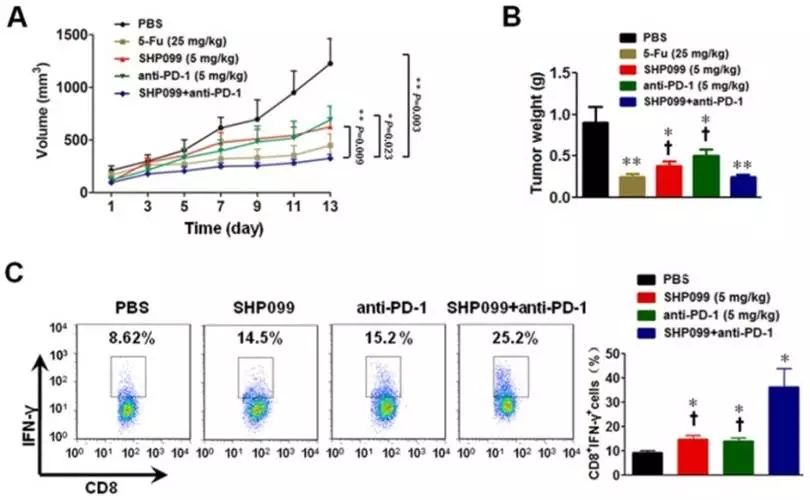
图9.
SHP2抑制可协同
anti-PD-1疗效
应该指出,在本研究中所使用的鼠源结肠癌细胞MC-38以及CT-26对于SHP099而言属于相对不敏感的细胞株,SHP099的抗肿瘤效应主要以增强
T细胞介导的
抗肿瘤
免疫为主。
考虑到临床上存在一些对SHP2抑制剂敏感的protein receptor tyrosine kinase (RTK) 依赖型的肿瘤类型
,
SHP099一方面可抑制肿瘤细胞中的SHP2,下调Ras-ERK通路抑制肿瘤细胞的增殖,另一方面亦可通过抑制T细胞的SHP2从而恢复甚至增强
T细胞介导的
抗肿瘤
免疫,从而起到双管齐下,一石二鸟的作用(图10)。
图10. SHP2抑制可同时影响癌细胞和T细胞
该研究提示靶向抑制SHP2有望成为肿瘤免疫治疗的新手段,同时也为免疫检查点的组合疗法提供了新的备选方案。