
问题:
怎样才能让我的工作学习更有效率呢??
答案:
只需要点击图片上边蓝字
一药一世界
即可!
8月25日,CFDA发布《总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)》,就一致性评价的关键事宜及后续申报、审评工作流程进行了说明。
分析:
本次公告是一致性评价的第四个纲领性文件,标志着一致性评价的报审阶段正式拉开帷幕

本次是一致性评价的第四个纲领性文件,意义重大。自2015年11月,CFDA正式启动一致性评价工作以来,到目前为止共有四份纲领性文件,就评价的关键事宜逐渐进行规定、更新与确认:
上述系列发文围绕着审评时限、参比制剂、BE试验、特殊品种、通过评价后的政策优待等关键问题不断进行更新,本次100号文则是在一致性评价开展一年半之后,通过对实践的总结针对关键问题进行了一锤定音的确认(文件中明确说明“本公告自发布之日起实施,
原发布的一致性评价相关文件与此件不一致的,以此件为准
”
)。同时100号文也确认了后续的申报和审评流程,文件明确指出,“
自公告发布后第十个工作日起,一致性评价申请由国家食品药品监督管理总局行政事项受理服务和投诉举报中心负责受理或接收
”,标志着一致性评价的报审阶段正式拉开帷幕。
100号文未再提及审评时限相关内容
,包括此前文件中提到的289目录品种“原则上应在2018年底前完成一致性评价”、 其它品种“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请(实际上关于这点的说法,在过去这三次的文件中表述也在悄悄变化)”等。
这可能意味着不再对一致性评价的时限进行刻板规定,这也是出于对过去一年多企业在开展评价过程中遇到问题较多,进展普遍不乐观所作出的务实性调整。不设具体时间并不意味着企业可以放慢节奏,实际上100号文再次确认“同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种”,该规定一方面激励企业尽早开展评价以享受招标采购方面的优待,同时也仍是横亘在所有企业面前的生死时限。若企业品种不能通过评价,则无缘集采市场,基本等同于文号被注销。
本次100号文对企业在开展一致性评价过程中遇到的系列疑问进行了最后确认,将大大加快一致性评价进程,随着报审阶段拉开帷幕,药企间的竞争已进入肉搏阶段。
一致性评价的关键问题得以确认
100号文就一致性评价的系列关键问题进行了确认,解答了企业的疑虑,包括:参比制剂(按进口原研、经审核确定的原研地产化品种、未进口原研药品的顺序选择;CFDA已公告参比制剂的,企业无需再备案);BE试验(也可在其它具备条件的机构开展;BE开展前需在CDE指定网站进行登记;CFDA将分批公布BE豁免具体品种目录);支持中国境内企业生产的在欧盟、美国或日本批准上市的药品在中国上市(在中国境内同一条生产线同一处方工艺生产的,可直接以境外上市申报的技术资料进行申报,CFDA组织现场检查;非同一条生产线或处方工艺不同,可提出变更申请;尚未在中国境内上市的可以境外申报资料提出上市申请,需证实无种族差异)。
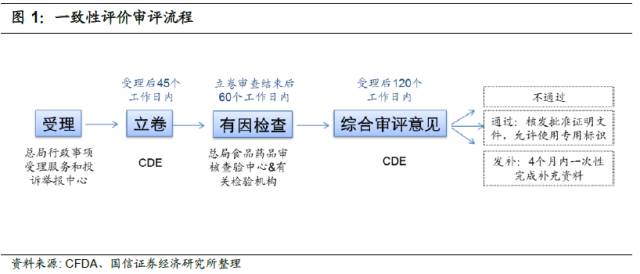
明确一致性评价的报审流程
100号文规定,自本公告发布后第十个工作日
(9月11日)起,CFDA将开始受理一致性评价申请
。具体流程如下:
一致性评价整体进展较慢,BE试验备案数量有限
近日,CFDA公布《关于企业开展289目录内仿制药质量和疗效一致性评价基本情况信息》,统计发现目前企业开展一致性评价的进展较慢,289目录中有15个品种尚无企业开展评价,有141个品种已开展评价的企业数量≤5家,37个品种已开展评价的企业数量在6~10家之间。考虑到一致性评价通过的难度,国内很多企业并不具备足够的制剂研发能力,实际可能会有较多品种在未来较长一段时间内难有合格产品能过评价(针对参评企业较少的品种,CFDA会出台相关鼓励政策)。

目前BE备案数量较少,预计后续将加快。对CDE临床试验登记平台的信息进行统计,选取相关上市公司进行检索,2016年以来企业备案的BE试验数量有限(一致性评价从2015年底启动,对BE试验的要求也相应提高,在2015年之前备案的试验由于设计方案不满足新规定等原因基本中止),并且其中大部分为新申报仿制药开展的BE试验,属于开展一致性评价备案的BE试验数量较少。但一些上市公司的重要品种进展较快,如信立泰的氯吡格雷、科伦药业的草酸艾司西酞普兰片、京新药业的瑞舒伐他汀钙片已完成或部分完成BE试验;另外,恒瑞医药、石药集团、华润双鹤、华东医药、国药致君等企业均已有多个品种进行了BE试验备案,目前正在进行中(平台登记可能会有滞后)。


















