
90%的癌症患者死亡是由于
肿瘤转移
,而非
原发肿瘤
造成,除非肿瘤原发于致命部位。长期以来,人们一直认为肿瘤的发生既可以由
胚胎形成之前就已存在的
种系
基因突变
遗传而来,也可以由
胚胎形成以后发生的体细胞基因突变
而来,而肿瘤的转移是由
肿瘤发生过程中出现的体细胞基因突变
驱动。因此,50多年来,科学家一直在寻找肿瘤内哪些体细胞基因突变可以让肿瘤细胞脱离原发肿瘤并通过血液和淋巴系统转移到全身。然而,与肿瘤发生或耐药不同的是,这种假定的体细胞转移驱动突变尚未被广泛的肿瘤基因测序确定,在转移灶及其对应原发肿瘤中观察到的驱动突变特征相似,
虽然患者的肿瘤充满了突变基因,但是没有一个基因被证明可特异地驱动转移
。这些发现虽然并不排除转移灶可能存在罕见的体细胞“驱动”突变的可能性,但是促使人们寻找其他替代机制。一种替代机制是个体之间的种系遗传差异是不同转移结局的基础,
驱动转移的突变可能不是在肿瘤本身的突变基因中发展,而是在患者正常的遗传基因中发展
,这可以解释迄今为止的观察结果,因为(1)种系遗传突变已经存在于原发肿瘤部位,不需要在转移部位“出现”,这可以解释转移灶和原发肿瘤的基因突变特征相似;(2)种系遗传在原发肿瘤和转移部位产生相似的蛋白质,将向癌细胞发出信号,并在两个部位产生一致的促转移基因表达程序,这可以解释在原发肿瘤及其对应转移灶观察到的基因表达程序相似。小鼠观察研究结果支持种系遗传影响转移的作用,例如长期以来人们一直观察到遗传背景可以影响小鼠乳腺癌模型的转移率。确定可能影响人类癌症转移结局的种系遗传差异是更艰巨的挑战,因为人类与小鼠相比,遗传突变数量庞大,限制了确定癌症结局遗传关联的统计能力。提高检测关联统计能力的方法之一是关注常见的种系突变,事实上最近的研究发现
载脂蛋白E
编码基因常见种系突变对黑色素瘤进展和转移有不同的影响,并与人类
黑色素瘤
患者生存显著相关。因此,科学家假设常见的种系基因突变(而非肿瘤基因突变)可能是
乳腺癌
转移结局的基础,并设计系统方法寻找这种因果突变。
2024年12月9日,全球自然科学三大旗舰期刊之一、美国《细胞》正刊在线发表
美国洛克菲勒大学、瑞典隆德大学
的研究报告,首次发现一种
常见的人类基因种系突变
(而非
体细胞突变
)可驱动乳腺癌转移。
该研究在
PCSK9
基因中发现一种常见的种系错义突变
V474I
,存在于70%的白人女性种系细胞,与多个乳腺癌患者人群
生存率降低
显著相关。PCSK9基因编码的蛋白质主要功能是
结合并降解低密度脂蛋白受体
,一旦发生突变,可以引起
家族性高胆固醇血症
以及
冠状动脉疾病
。
用人类PCSK9相关突变基因对小鼠进行遗传建模表明,这种获得功能单核苷酸突变与乳腺癌转移有因果关系。相反,宿主PCSK9缺失可减少小鼠三阴性乳腺癌
4T1
和小鼠髓样乳腺癌
EO771
以及人类三阴性乳腺癌
MDA231
等多种乳腺癌模型的转移克隆。
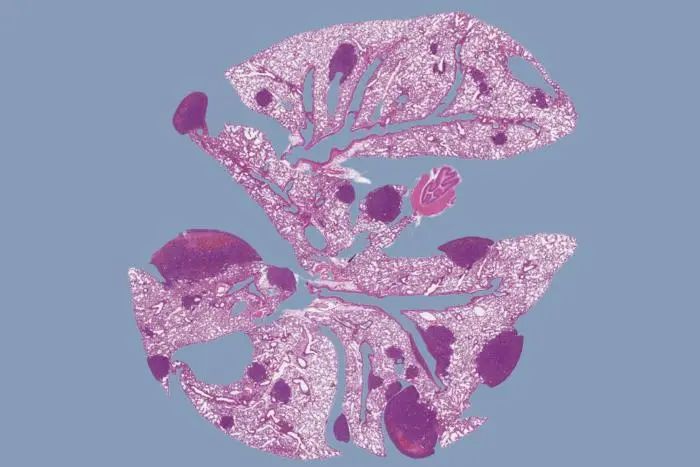
通过基因工程将小鼠改造为携带人类PCSK9基因突变时,其乳腺癌转移显著增加,这些小鼠肺组织图像显示PCSK9的影响。
根据机制分析,PCSK9突变可以
促进肺部转移起始事件
,并且
增强转移增殖能力
,这些作用主要通过
降解肿瘤低密度脂蛋白受体相关蛋白质LRP1受体
,而该受体能够抑制促进转移的基因
XAF1
和
USP18
。有趣的是,作者之前对黑色素瘤的研究发现,促进或抑制转移的载脂蛋白E等位基因也作用于
LRP1
,两种不同癌症的转移机制都集中于同一受体。

利用PCSK9抑制剂
依洛尤单抗
可以防止多种乳腺癌小鼠模型的乳腺癌转移。值得注意的是,依洛尤单抗已经获得批准用于治疗
高胆固醇血症
,安全有效且耐受性良好,故有必要进一步开展临床研究验证其对癌症转移的疗效。
根据瑞典大样本早期乳腺癌队列研究,上述突变纯合子患者15年内发生远处转移复发风险为
22%
,而非纯合子患者风险仅
2%
。
因此,该研究结果表明,这种常见的遗传基因突变控制着乳腺癌转移,并可预测生存率和生远处转移复发风险,揭示了乳腺癌转移的遗传基础。
癌症转移
至少在一定程度上是
可遗传疾病
,过去我们过于关注
肿瘤细胞(种子)
而忽略了
种系细胞(土壤)
,而现在关注“土壤”至关重要。该研究结果还强调了国际合作的重要性,国际合作涉及来自多个国家的研究者和患者人群,这证明人类遗传学已经变得多么强大,随着将计算分析与实验模型相结合的新技术问世,我们正处于解答难题的伟大时代。















