诱导肿瘤细胞凋亡,一直以来是各类肿瘤免疫治疗的根本目标。但这一定是对的吗?如果不对,我们是否需要改变药物研发和临床治疗的策略?
肿瘤细胞主动死亡
近年来,科学家们发现一些预后不良的
高级别癌症
往往包含相对
高水平凋亡细胞
。有人提出死亡的肿瘤细胞有助于肿瘤种群整体的净生存、扩张和进化,可能是
肿瘤的一个主动行为。
Cancer Cell上,
阿拉巴马大学伯明翰分校的一些研究者就发现,凋亡的胶质母细胞瘤会释放胞外囊泡,含有恶性促肿瘤的剪切碎片,它再转入存活的胶质母细胞瘤细胞,促进他们发生恶性表型改变,并对治疗产生抗性。
作者发现胶质母细胞瘤中超过70%的肿瘤细胞会发生凋亡。
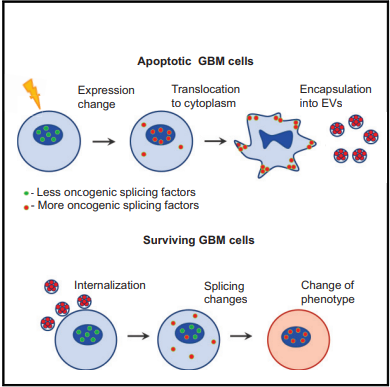
英国爱丁堡大学Catriona A. Ford等则认为凋亡的淋巴瘤细胞和肿瘤相关巨噬细胞会促进肿瘤细胞生长,血管生成,对抗肿瘤免疫产生抑制。凋亡的淋巴瘤细胞会激活肿瘤相关巨噬细胞,释放基质金属蛋白酶(MMP2和MMP12等)促进组织重构和转移。
伯基特淋巴瘤是增长最快的人类癌症之一,但是其通过凋亡丢失的细胞约占总增量细胞的70%。
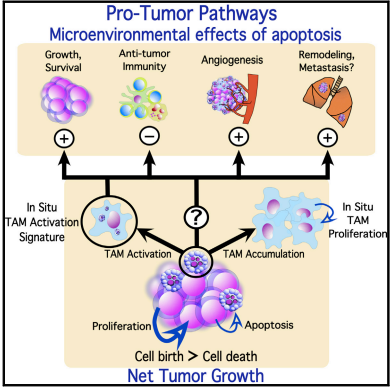
促进肿瘤细胞凋亡和抗肿瘤作用在某些条件下是一个悖论(Apoptosis Paradox)。目前至少发现在10种肿瘤存在这种悖论,包括膀胱癌、乳腺癌、结肠直肠癌、胃癌、胶质母细胞瘤、恶性间皮瘤、NHL、非小细胞肺癌、胰腺管癌、舌鳞状癌。
根据Paget’s的种子和土壤概念,原发性和转移性癌症的发展从根本上依赖于肿瘤的“生态位”,即肿瘤微环境。
凋亡是肿瘤微环境的一个共同特征
,其次,在多个
较高凋亡水平的
肿瘤更具侵袭性
。
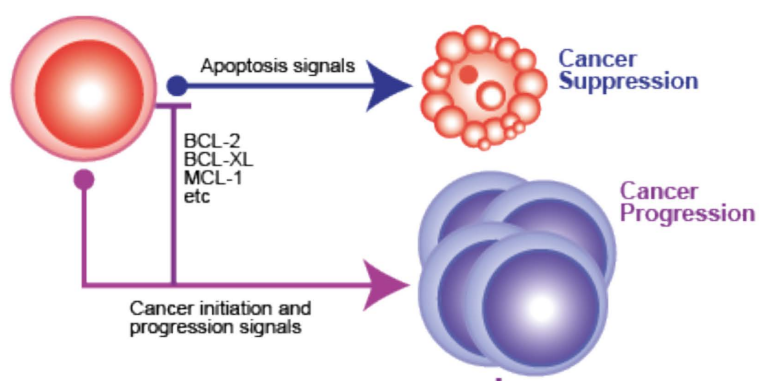
虽然恶性疾病的侵袭性和肿瘤细胞凋亡水平之间的因果关系仍然很大程度上是理论上的,即促凋亡分子的高表达可能与疾病的低侵袭性不相关,反之亦然。比如,促凋亡的Bax表达或Caspase激活与侵袭性疾病相关,而抗凋亡的Bcl-2与较低的侵袭性状态相关。
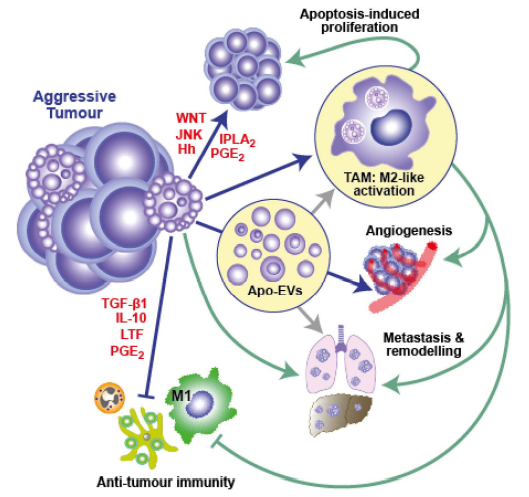
细胞死亡可能促进基因组的不稳定性和
创建新的生态位
(Onco-Regenerative Niche ,ORN),导致更具有侵袭性的肿瘤细胞增殖,形成新克隆重新聚集。分泌的凋亡囊泡可以促进血管新生,激活肿瘤相关巨噬细胞,诱导肿瘤微环境重构,转移。
简评:诱导凋亡是我们抗肿瘤治疗一直以来的目标和策略。但是肿瘤细胞也通过主动诱导凋亡形成促进其生长转移的新生态位。所以,单纯的凋亡可能无法给我抗肿瘤治疗成或败的信息。那么,诱导凋亡的细胞毒性药物(小分子或者大分子)还会是研究和开发的重点吗?



参考文献
-
Pavlyukov, M.S.; Yu, H.; Bastola, S.; Minata, M.; Shender, V.O.; Lee, Y.; Zhang, S.; Wang, J.; Komarova, S.; Wang, J.; et al. Apoptotic
Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors. Cancer Cell.
2018, 34, 119–135.e10
-
Ford, C.A.; Petrova, S.; Pound, J.D.; Voss, J.J.; Melville, L.; Paterson, M.; Farnworth, S.L.; Gallimore, A.M.; Cuff, S.; Wheadon,
H.; et al. Oncogenic properties of apoptotic tumor cells in aggressive B cell lymphoma. Curr. Biol. 2015, 25, 577–588
-
Morana, O.; Wood, W.;
Gregory, C.D. The Apoptosis Paradox
in Cancer. Int. J. Mol. Sci. 2022, 23,
1328. https://doi.org/10.3390/
ijms23031328
-
本周好文推荐
如需转载请联系佰傲谷并在醒目位置注明出处

















