广州药交会最值得期待的2场策略会:
【策略会一】二次议价药企应对策略会(11月26日)
【策略会二】两票制+医药代表备案制下CSO的合规运营策略会(11月27日)
更多详情可咨询:180-2869-1034; 180-2869-1045(微信同号)
医药云端工作室:挖掘趋势中的价值
来源:CFDA

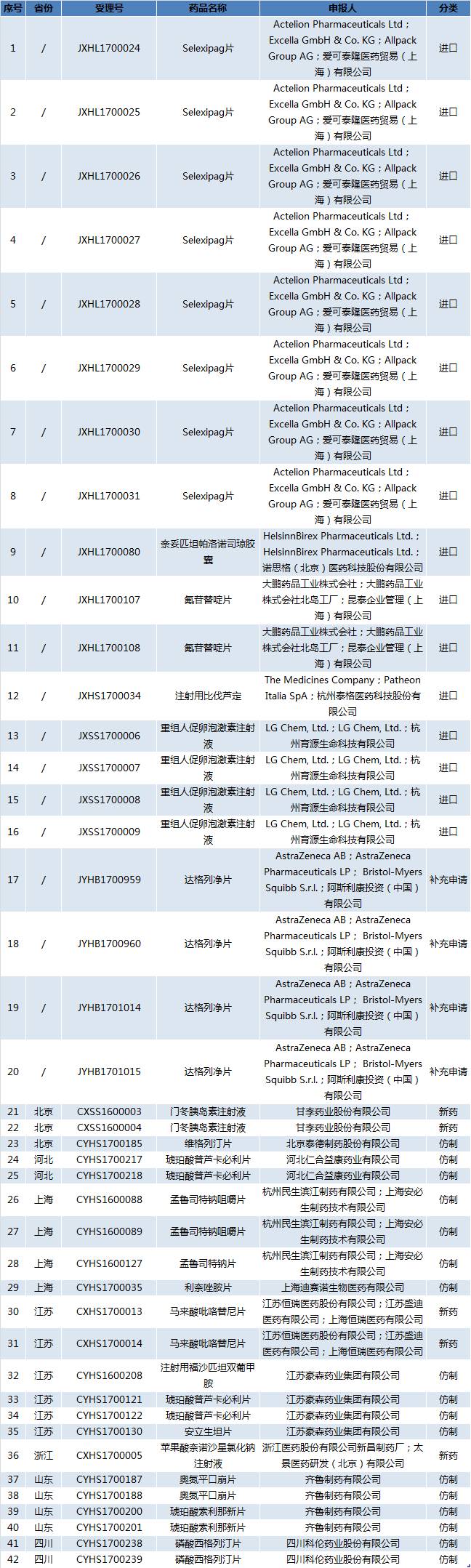
今日(10月30日),国家药监总局发布关于药物临床试验数据自查核查注册申
请情况的公告,决定对新收到42个已完成临床试验申报生产或进口的药品注册申请进行临床试验数据核查。其中补充申请有4个、仿制17个、进口16个、新药5个。
自2015年7月22日,总局印发了《关于开展药物临床试验数据自查核查工作的公告》,决定对已完成临床试验正式申报生产或进口,在药品审评中心等待审评的1622个药品注册申请开展药物临床试验数据自查核查。这标志药物临床数据自查核查工作正式开展。随后CFDA又相继发布29个公告,指导并通报临床试验数据自查核查工作的开展情况。
自查结果:超过六成申请人主动撤回注册申请。目前CFDA已发布9期公告,要求对2116个已申报生产或进口的待审药品注册开展物临床试验数据自查核查工作。截止2017年6月底,除258个申请减免临床试验等不需要核查的注册申请外,申请人药物临床数据自查后主动撤回的注册申请有1316个,占62.2%;仅542个品种需要进行现场核查。
核查结果:13期现场核查计划中约1/3注册申请已有审评结果截止2017年8月,CFDA审核查验中心共发布13期药物临床试验数据现场核查计划,总计382个品种。
其中,企业撤回注册申请42个,CFDA批准进口43个,批准生产18个,批准临床5个,不批准8个,暂无审评结论的266个。换言之,已有审评审批结果的药品注册申请占30.3%,有69.7%的药品注册申请暂无审评结论。
截止今年6月药品核查工作已完成进度的60%截止2017年6月底,542个待核查品种已核查313个,占57.7%。在已核查的药品注册申请中,新药注册申请94个,仿制药注册申请37个,进口药注册申请182个。
其中涉嫌临床试验数据造假的品种共计38个,仿制药注册申请的临床试验数据涉嫌造假现象最为严重。
主要问题为临床部分缺陷项居多,问题较为集中根据313个药品注册申请的现场核查报告,共发现5111条缺陷项,其中临床部分4583条,生物分析部分528条。
对缺陷项进行分类,发现临床试验过程记录及临床检查、化验等数据溯源方面、方案违背方面、试验用药品管理过程与记录方面和安全性记录、报告方面问题较多,占61.8%。
总局关于药物临床试验数据自查核查注册申请情况的公告(2017年第128号)
相关事宜公告如下:
一、在国家食品药品监督管理总局组织核查前,药品注册申请人自查发现药物临床试验数据存在真实性问题的,应主动撤回注册申请,国家食品药品监督管理总局公布其名单,不追究其责任。
二、国家食品药品监督管理总局食品药品审核查验中心将在其网站公示现场核查计划,并告知药品注册申请人及其所在地省级食品药品监管部门,公示10个工作日后该中心将通知现场核查日期,不再接受药品注册申请人的撤回申请。
三、国家食品药品监督管理总局将对药物临床试验数据现场核查中发现数据造假的申请人、药物临床试验责任人和管理人、合同研究组织责任人从重处理,并追究未能有效履职的食品药品监管部门核查人员的责任。
附件:42个药物临床试验数据自查核查注册申请清单
广州药交会最值得期待的2场策略会:
【策略会一】二次议价药企应对策略会(11月26日)
【策略会二】两票制+医药代表备案制下CSO的合规运营策略会(11月27日)
更多详情可咨询:180-2869-1034; 180-2869-1045(微信同号)
报名请点击阅读原文
↓↓↓↓↓













