3月资源包:
关注 "
解
螺旋
" 微信公众号,回复关键词
"
3月"
可索取DNA序列分析软件。
Discussion写作模板
|
SCI作图
|
qPCR曲线
|
自噬相关mTOR信号
|
ELISA实验

编辑:子非鱼(转载请注:解螺旋·医生科研助手)
自去年诺奖谢幕之后,自噬作为细胞内的清道夫并维持细胞内稳态,便广为人知。一般自噬作为吸尘器,尽职尽责地清除“废物”以保证家里(细胞)的清洁。俗语云,有压迫就会有反抗。重压之下,自噬也逐渐露出其狰狞面容,肿瘤、神经退行性疾病等便接踵而来。
Science近期的一篇好文则将压力之下,自噬误入歧途的心里路程(信号通路)阐释的清清楚楚,以期在各位科研者的帮助下,自噬这位浪子能够早日被拉回正轨。
话说,细胞这个吃货平常就喜欢自己吃自己玩,通常仅仅是基础性自噬(basal autophagy)每小时可分解掉细胞内1%到1.5%的代谢物质。尤其当压力倍增时,比如在面临营养饥饿、代谢失衡、缺氧、氧化应激、致癌基因激活等情况时,自噬相关蛋白(ATG)就会撸起袖子,使劲拉拢各路转录因子如P53,FOXO,MiT/TFE,Nrf2和NFkB/Rel等,并开启吃霸王餐模式,以希望化压力为食量。换言之,自噬反应是细胞应答应激反应的一项有利武器。

既如此,不如就先看看细胞这个吃货是怎么练成的吧(见上图)!
显然,当mTORC1处于非活化状态时,便解开了起始复合物的封印,随后起始复合物便迁移至新生吞噬膜(带有ATG14和VMP1蛋白)。
接着,ATG14在ULK1/2的作用下磷酸化,并招募Beclin1蛋白以及Vps34/15蛋白,以形成磷脂酰肌醇激酶3(PI3K)小团队,专干着使磷脂酰肌醇磷酸化(PI3P)的活儿,并接收ATG9依赖性的内吞小泡做小弟。
同时,一些短暂形成类泛素连接产物,如ATG12-ATG5-ATG16和LC3-PE复合物也因PI3P慕名而来。原本,LC3-PE蛋白跟ATG12-ATG5-ATG16&PI3K蛋白一样,只图个做好事不留名,贡献力量之后便默默消失。但世事难料,这一点只有位于吞噬膜朝向胞质的LC3-PE真正做到了(LC3会被及时清除),而并非朝向胞质的LC3-PE则在多泛素化蛋白聚合物的p62怂恿下定居于吞噬膜上。而吞噬膜也在p62蛋白的相互作用下延伸并封闭为一个吞噬囊泡,当其遇到溶酶体后,便可降解被隔离的物质以饱餐一顿。

众所周知,mTORC1在自噬信号通路中那是响当当的核心人物。殊不知,为了细胞生长大业,它还身兼监察重任,比如生长因子刺激、DNA损伤、能量状态(ATP/AMP比值)、氨基酸浓度(通过质子泵V-ATPase)、活性氧自由基(ROS)浓度等检测统统都在它的掌控之中。尽管大多数时候它都会通过磷酸化靶物质来促进生物合成,但是对于自噬,它偏偏要反其道而行之,其活化状态可磷酸化并抑制ULK1/2和ATG13蛋白活性,进而使得自噬难以被启动。
而它为了维持自身活化的状态,极其需要Rheb蛋白以及定位于溶酶体的Rag蛋白(GTPase)的鼎力相助下。而受Rag蛋白招募的TSC1/2蛋白(GTPase活化蛋白,GAP)恰好又是mTORC1活化的另一位左膀右臂。它对Rheb蛋白的GTP结合形式的维持,对mTORC1活化态是非常必要的;一旦当Rheb-GTP形式被磷酸化的TSC1/2转为Rheb-GDP形式时,mTORC1也会在被释放的同时失去其活性,进而启动自噬反应。
此时,就不得不提及其上游的两种蛋白AKT和AMPK。AMPK堪称是家喻户晓的明星大腕,其刺激信号如糖原缺乏(AMP/ATP比值升高)、高浓度ROS、DNA损伤(DDR)均可使其活化,随后磷酸化TSC1/2并开启自噬模式。可见,自噬反应在应对各种压力源的过程中处于核心地位,而这恰是因为几乎任何细胞功能障碍、代谢不平衡均会导致线粒体释放ROS,并触发自噬反应。
1.ATG7&ATG5在应激反应中对p53通路的影响

通常AMPK是肿瘤抑制蛋白p53的下游蛋白。而p53之所以在所有的应激反应中都能发挥重要作用,不仅仅是因为它反式激活有关细胞代谢、自噬和凋亡中许多重要的转录因子基因,也是因为它能成为细胞质中的效应因子。
压力应激后,p53对Sesn1和Sesn2基因的反式激活可激活AMPK并促进自噬反应;同时,在ATG7辅助下,p53反式激活转录因子p21CDKN1A的表达,进而导致G1和G2细胞周期停滞。 而ATG5也可增加p53丰度,磷酸化后伴随着p21CDKN1A反式激活。另外,胞质中也存在着磷酸化p53,在激活LKB1后,可促使AMPK活化;且异位表达ATG7和ATG5也均能诱导自噬。

2. ATG7 介导FOXO1的负反馈调节

FOXO转录因子在压力条件下可激活许多参与自噬的重要基因。转录因子FOXO3可拮抗FOXO1在细胞核中的表达,从而抑制自噬。但在由氧化应激(ROS)引起的脱乙酰酶Sirt2失活后,乙酰化FOXO1(FOXO1-Ac)则积聚在细胞质中并与ATG7复合,进而可刺激自噬发生。这种自噬诱导机制因使得FOXO1在细胞质中保留转录因子失活的状态,从而可抑制裸鼠中的肿瘤异种移植物生长。此外,ATG7在泛素化样共轭反应中的激活,可形成ATG5-ATG12复合物和LC3-磷脂酰乙醇胺(LC3-PE),其对于自噬体的形成和闭合至关重要。
3. p62依赖性选择性自噬在应激反应途径中产生Nrf2扩增的反馈环

选择性自噬的基础是依赖于p62和相关的自噬受体/衔接蛋白的特异性,其中,p62与线粒体功能失调和ROS的增加有关,调节应激反应中抗氧化作用。另外,p62也是一种需要通过自噬消化降解的底物,否则一旦p62过量就会诱导ROS产生、DNA损伤、非整倍体和肿瘤发生。
因此,为了维持细胞的氧化还原平衡,自噬过程中也存在着一种前馈途径。当ROS浓度升高时,编码p62的SQSTM1基因可由转录因子Nrf2反式激活,在整体抗氧化和解毒反应中起着重要作用。另外,p62也可调控Nrf2的丰度:当泛蛋白连接酶Keap1靶向Nrf2后会被26S蛋白酶体降解;而p62在与Keap1结合后,可将其与其他泛素化蛋白质的聚集体一起螯合在生长中的吞噬膜中用于快速降解。另外,也通过SESN2结合激活或磷酸化后,p62对Keap1的亲和力增加,从而通过增加Keap1降解速率来增强正反馈环。
4.线粒体自噬时,转录因子MiT / TFE的调控取决于ATG5/9蛋白

线粒体自噬时,增加了对自噬和溶酶体蛋白的需求,而这些蛋白基因的表达取决于转录因子的MiT/TFE家族(以TFEB为例)。当其通过活性mTORC1磷酸化后,可与伴侣14-3-3保留在细胞质中。在线粒体功能障碍后,随着ROS生成,激酶PINK1磷酸化E3泛素连接酶parkin,将其募集到线粒体外膜,并泛素化许多线粒体表面蛋白,使其作为自噬受体/适配器(p62和optineurin)的靶标,引导形成早期吞噬小体。
TFEB激活和易位进入细胞核取决于parkin,ATG5和ATG9的相互作用,并能反式激活许多溶酶体和自噬基因。尽管有证据表明两种ATG也进入细胞核,ATG5/ATG9在促成吞噬小体形成过程中更可能的作用是促使TFEB移位入核。另外,葡萄糖剥夺也可刺激TFEB活化和易位,但不依赖于ATG5和ATG9蛋白。
5.自噬和NFkB / IKK激活是相互依存的
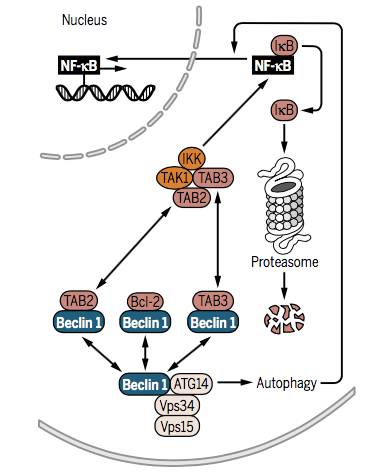
NFkB确实可反式激活许多自噬相关基因(如Beclin 1 ),因而,NFkB相关的炎症反应信号通路与自噬信号通路是有重叠的。
通常胞质中的NFkB与其抑制剂IkB结合,当它被IKK复合物激活,置换出的IkB会被蛋白酶体降解,从而活化NFkB并使其易位进入细胞核。但IKK的活化需要TGF-b激活激酶1(TAK1)及其辅因子TAB2和TAB3。又因TAB2/TAB3也可与Beclin 1形成复合物(抗凋亡因子Bcl-2也可与Beclin 1结合),所以NFkB激活只能是这些平衡发生变化的结果,且会与自噬反应平行发生,即将TAB2/TAB3应用于 IKK激活的同时,释放Beclin 1启动自噬。
6.UVRAG可作为调节自噬和癌症不同功能的枢纽
由于积累毒性蛋白质聚集体,功能失调的线粒体和ROS,自噬性缺陷可导致细胞中的非整倍体和致癌转化。但自噬也可通过紫外线辐射抗性相关基因(UVRAG)特异性地保护基因组不稳定性。
UVRAG可参与Beclin 1和Vps34形成复合物PI3K,有助于启动自噬形成。而UVRAG的另一个亚型可以结合DNA依赖性蛋白激酶(识别DNA损伤位点和NHEJ的关键酶),并参与中心体的保护。此外,UVRAG不仅在自噬起始中发挥作用,还可调节自噬体成熟的晚期。在内吞小体和溶酶体融合中,被mTORC1磷酸化UVRAG可阻止进一步的自噬体成熟和与溶酶体的融合,进而控制自噬降解速率。
总之,自噬是与应激反应网络紧密结合的一条途径,其ATG蛋白确可在整个应激网络中调节和扩增各种转录因子的活性。
比如Beclin 1可竞争性地结合涉及NFkB活化的各种蛋白质,并作为细胞凋亡和自噬之间的平衡点;ATG5增加p53丰度和活化,不仅启动转录应激反应与自噬,还可与survivin蛋白相互作用以引起染色体移动复合物功能障碍;ATG7是p21CDKN1A的p53依赖性反式激活和DDR中生长停滞所必需的必需辅助蛋白,而ATG5和ATG7也可通过抑制促凋亡基因(Puma,Noxa和Bax)的p53依赖性反式激活来抑制细胞凋亡;ATG7与乙酰化的FOXO1相互作用诱导自噬等。因而,本文也希冀能通过对自噬与压力应激之间的相关了解为今后进行自噬靶向癌症治疗提供一份理论依据。
参考文献:Retrograde signaling from autophagy modulates stress responses







