沮丧,懊恼,颓废,失落,秒变无头苍蝇,将这些阴性结果彻底打入冷宫,老死不相往来。无奈之下,科研狗们只能收拾心情,从头再来,开启新一轮的方案设计和实验,祈祷阳性结果出现。
如此反复几次,耗时耗力的同时,也耗尽了对科研的热情。这种困境如何破,今天米粒儿带大家一起研究一篇《Cancer research》的论文(Heterogeneous Stromal Signaling within the Tumor Microenvironment Controls the Metastasis of Pancreatic Cancer),学习如何轻松跳出阴性结果的坑。
这篇文章主要关注肿瘤微环境中异质性表达的间质通路如何调控胰腺癌转移。间质信号HGF和IGF-1通过调节Src和IGF-1R激酶活性提高胰腺相关蛋白Annexin A2(AneA2)的磷酸化水平。
同时抑制HGF和IGF-1信号通路可抑制AneA2的磷酸化水平,继而显著抑制胰腺导管腺癌(PDAC)侵袭转移能力(图1)。
以上实验结果主要明晰了间质和肿瘤的相互作用,为PDAC间质直接治疗提供理论依据。
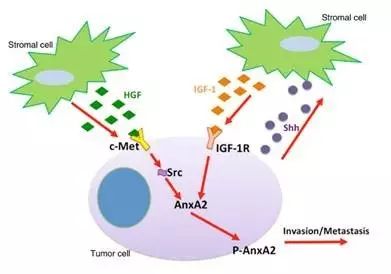
图1 机制图。间质细胞分泌出IGF-1和HGF ,二者共同调节AnxA2的磷酸化水平,进而影响前列腺癌的侵袭和迁移能力相关。
AneA2的络氨酸23位点(Y23)的磷酸化对其细胞膜转位以及PDAC的侵袭转移能力的形成都是必须的。但是AneA2如何被磷酸化,它的上游分子是什么,这一科学问题还未完全阐释。
本文实验设计中,作者通过文献调研确定了AneA2的2个上游调节通路,分别为Hh/IGF-1/IGF-1R,HGF/c-Met/Src。
对于此类的课题设计,通常从表型实验开始。首先需要确定两个基本的前提假设:
第一:Hh/IGF-1/IGF-1R,HGF/c-Met/Src可参与AneA2的磷酸化调节
第二:IGF-1,HGF影响肿瘤的增值,侵袭和转移能力。
本文作者也对这两个假设进行验证
假设一验证:在体内试验中,作者采用两个PDAC小鼠模型(KPC mice和Orthotopic implant model),分别加入Hh抑制剂和c-Met抑制剂后,检测AneA2的磷酸化水平。
结果发现,无论是加入Hh抑制剂还是c-Met抑制剂,都不影响AneA2磷酸化水平(图2)。

图2 Hh/IGF-1/IGF-1R,HGF/c-Met/Src对AneA2的磷酸化的调节
假设二验证:在Orthotopic implant model中,作者分别加入Hh抑制剂和c-Met抑制剂后,检测肿瘤体积,转移细胞数。
结果发现,无论是加入Hh抑制剂还是c-Met抑制剂,对肿瘤体积和转移都没有显著影响(图3)。

图3 IGF-1,HGF对肿瘤的增值,侵袭和转移能力的影响
由以上两个假设验证结果,我们可以看到,这两个表型实验的结果均与预期结果相反,即为阴性结果。
那么,重点来了,作者是如何跳出阴性结果的坑呢?
其实答案很简单,作者在原来实验的基础上仅仅多做一步,将Hh抑制剂和c-Met抑制剂同时加入实验体系中,又重新进行以上两个实验。
随即得到理想的实验结果,AneA2的磷酸化水平显著降低,肿瘤体积和转移能力也发生明显改变(图2和图3)。
为什么出现这样的实验现象呢?这就要从肿瘤间质和肿瘤异质性说起了。
肿瘤间质成分不具特异性,起着支持和营养肿瘤实质的作用。肿瘤的间质一般由结缔组织和血管组成。
PDAC中结缔组织间质占肿瘤体积的60%-90%,在PDAC的发生和发展中起关键作用。
所谓肿瘤异质性是指肿瘤在生长过程中,经过多次分裂增殖,其子细胞呈现出分子生物学或基因方面的改变,从而使肿瘤的生长速度、侵袭能力、对药物的敏感性、预后等各方面产生差异。它是恶性肿瘤的特征之一。
本文中提到的IGF-1是由 Sonic Hedgehog pathway (Shh)调节。Shh和HGF在PDAC的间质中呈现异质性表达(如图4所示)。除了异质性表达之外,二者表达还呈现明显的互补性(表1),即Shh表达低的肿瘤中,HGF表达量高;Shh表达高的肿瘤中,HGF表达量低。
Shh和HGF在体内异质性和互补性表达特性决定二者共同调控AneA2磷酸化,所以在体内必须同时抑制Shh和HGF才能完全抑制AneA2磷酸化,从而抑制肿瘤的转移。
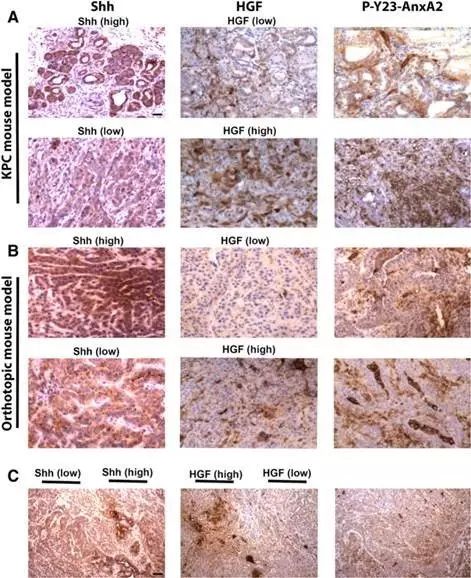
图4 Shh和HGF在体内呈现异质性表达
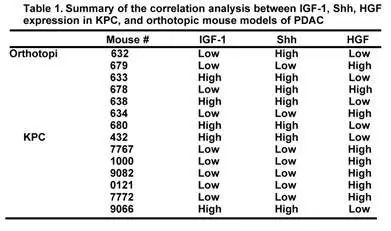
表1 Shh和HGF在体内表达呈现互补性
有相当比例的研究人员在课题设计时往往存在着这样的问题:他们在课题设计通常只设计一条通路,如果这条通路走不通,则重新再选另外一条通路。如此反复,直至得到理想实验结果为止。
这样的课题设计有着明显的"撞大运"成分。但是,如果将肿瘤异质性和间质表达互补性两个理念植入课题设计中,则有效的提高工作效率。
当A通路得到阴性结果时,通过文献调研或者生物信息学分析,寻找与A互补性表达的B通路,并通过实验证明是否A、B通路共同调节下游分子表达。
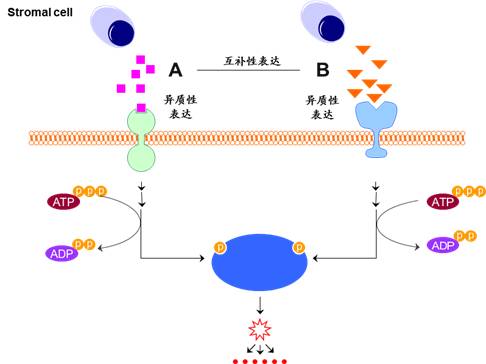
图5肿瘤异质性和间质表达互补性相关课题设计套路















