健康人体内红细胞的数量约为20-30万亿,占人体细胞总数的80%左右,每秒新生成约240万个成熟红细胞,以维持气体交换、代谢平衡等关键生理功能。红细胞生成(erythropoiesis)起始于多能造血干细胞(HSC)向红系前体细胞的分化,随后经历一系列显著的形态与功能改变,包括质膜的特化、大部分细胞器的清除、蛋白质组的收缩,以及合成占胞质蛋白总量95%以上的血红蛋白【1,2】。这一过程中精细的代谢调控,在确保细胞快速增殖和特化的同时生成功能性成熟红细胞。许多代谢酶的基因缺陷(如葡萄糖-6-磷酸脱氢酶)会引发红细胞功能异常,常见的红细胞遗传性疾病(如β-地中海贫血)通常表现出特定的代谢紊乱。因此,系统性解析红细胞发育和成熟过程中的代谢调控机制及其在疾病中的代谢重编程,有助于加深对正常细胞发育过程的理解,并为红细胞相关疾病的治疗提供新的方向和策略。
2024年11月15日,美国圣裘德儿童医院徐剑(Jian Xu)团队在Science 正式刊发题为A Glutamine Metabolic Switch Supports Erythropoiesis的研究论文。该研究发现,在红细胞的定向分化和成熟过程中,基因转录和代谢水平上发生了显著的从谷氨酰胺分解代谢到合成代谢的转换。谷氨酰胺合成酶(GS)活性增强有助于降解血红素生物合成过程中产生的毒性铵离子,以促进红细胞的发育成熟。而在β-地中海贫血中,由于氧化应激引起的谷氨酰胺合成酶活性受损,导致谷氨酸和铵离子的累积。增强谷氨酰胺合成酶的活性可以有效缓解β-地中海贫血引发的代谢异常和病理缺陷。该研究不仅揭示了红细胞在正常发育和相关疾病中的代谢调控机制,也为未来基于代谢靶向的红细胞疾病治疗策略的开发提供了新的研究思路。

研究人员在红细胞定向分化和成熟过程中各个阶段分析了基因转录和代谢水平的变化,并通过整合转录组与代谢组的网络分析,发现谷氨酰胺分解代谢向合成代谢的转换与红细胞分化和成熟高度相关。其中,与谷氨酰胺分解代谢相关的基因及其代谢产物谷氨酸在红细胞分化过程中逐渐减少,而谷氨酰胺合成酶及其代谢产物谷氨酰胺则逐步增加。谷氨酰胺合成酶在细胞质中催化谷氨酸和铵离子结合生成谷氨酰胺。进一步研究显示,特异性敲除血液前体细胞和红系前体细胞中的谷氨酰胺合成酶会导致红细胞分化受阻、铵离子累积以及细胞内活性氧(ROS)增加。在氧化剂苯肼诱导的溶血性贫血模型中,红系特异性缺失谷氨酰胺合成酶也会导致红细胞恢复延迟,并伴随谷氨酸和铵离子积累、谷氨酰胺减少以及谷氨酰胺与谷氨酸(Q-E)比值的下降。
为了深入解析代谢过程如何促进病理性红细胞生成,研究人员对正常和β-地中海贫血小鼠的红系细胞进行了代谢组学分析。结果表明,β-地中海贫血小鼠的红系细胞中,谷氨酰胺和谷氨酸代谢是变化最显著的代谢通路之一。在代谢产物含量上,β-地中海贫血小鼠的红系细胞中谷氨酸含量增加和谷氨酰胺与谷氨酸(Q-E)的比率降低。同样,在β-地中海贫血(TDT)患者的红系细胞中也观察到了相似的代谢特征。
以上结果表明,β-地中海贫血小鼠和患者中观察到的谷氨酰胺代谢缺陷与谷氨酰胺合成酶特异性敲除小鼠的表型相似。尽管正常小鼠和β-地中海贫血小鼠的红系细胞中谷氨酰胺合成酶mRNA和蛋白丰度相似,但后者的谷氨酰胺合成酶活性显著降低,提示β-地中海贫血小鼠和患者中谷氨酰胺合成酶功能受损。在β-地中海贫血中,过量的游离α-珠蛋白、血红素和铁的累积导致细胞内ROS的增加,ROS可以修饰氨基酸侧链从而损害蛋白的功能。进一步的蛋白质谱分析证实,谷氨酰胺合成酶的346位半胱氨酸(Cys-346)被氧化,破坏了其与252位半胱氨酸(Cys-252)二硫键的形成以及与底物结合的能力,从而影响了酶的催化活性。抗氧化剂N-乙酰半胱氨酸处理β-地中海贫血小鼠后,在显著降低ROS水平和增强谷氨酰胺合成酶活性的同时,外周血中铵离子浓度明显降低、谷氨酰胺与谷氨酸比值相应升高,以及红细胞分化和成熟得到改善。与之类似,在β-地中海贫血小鼠的多能造血干/祖细胞中过表达谷氨酰胺合成酶后进行受体移植实验,也证实增强谷氨酰胺合成酶活性能够部分恢复受体鼠内ROS和铵离子的水平,促进红细胞分化成熟,并显著改善β-地中海贫血小鼠的血液表型。
研究过程中发现,红细胞分化成熟过程中谷氨酰胺合成酶的上调和特异性敲除小鼠中谷氨酰胺合成酶的缺失,均可导致红系细胞中谷氨酸含量以及谷氨酰胺与谷氨酸(Q-E)比值的显著变化。类似地,在β-地中海贫血小鼠和患者样品中,或者在经抗氧化剂处理、谷氨酰胺合成酶过表达处理、或临床一线药物罗特西普(Reblozyl,Luspatercept)治疗后,同样可以观察到红系细胞中谷氨酸含量和谷氨酰胺与谷氨酸(Q-E)比值的相应改变。因此,谷氨酸含量或谷氨酰胺与谷氨酸(Q-E)比值可作为评估红细胞正常或是异常发育的代谢标志物。同时,监测谷氨酸的含量或是谷氨酰胺与谷氨酸(Q-E)比值,对评估红细胞的成熟度和评价药物疗效方面具有潜在的应用价值。
在红细胞成熟过程中,需要合成大量血红素以生成血红蛋白分子。血红素生物合成起始于琥珀酰辅酶A(succinyl-CoA)和甘氨酸(glycine,Gly)反应生成5-氨基乙酰丙酸(5-ALA)。随后在细胞质中,卟啉原基因脱氨酶(HMBS)催化将卟啉原(PBG)头尾凝聚形成羟基甲基卟啉(HMB)并释放四个铵离子分子。作为最古老的功能基因之一,谷氨酰胺合成酶被认为是一个 “分子时钟”【3,4】。谷氨酰胺合成酶通过ATP水解将谷氨酸与铵离子结合生成谷氨酰胺。哺乳动物通常依赖谷氨酰胺合成酶活性和尿素循环来去除多余的铵离子【5,6】。然而,红细胞中并不表达关键的尿素循环酶,如氨基甲酰磷酸合成酶1(CPS1)、鸟氨酸转氨甲酰化酶(OTC)和精氨酸琥珀酸合成酶(ASS1)。因此,研究人员推测红细胞成熟过程中谷氨酰胺合成酶的活性上调用于铵离子解毒,作为一种进化保守的代谢适应机制来支持血红蛋白的合成和红细胞的成熟。进一步的[15N]标记的5-氨基乙酰丙酸体内示踪实验证实,红细胞成熟过程中,活化的谷氨酰胺合成酶利用血红素生物合成过程中产生的铵离子催化谷氨酸生成谷氨酰胺,从而保护红细胞免受铵离子累积的毒性损伤。
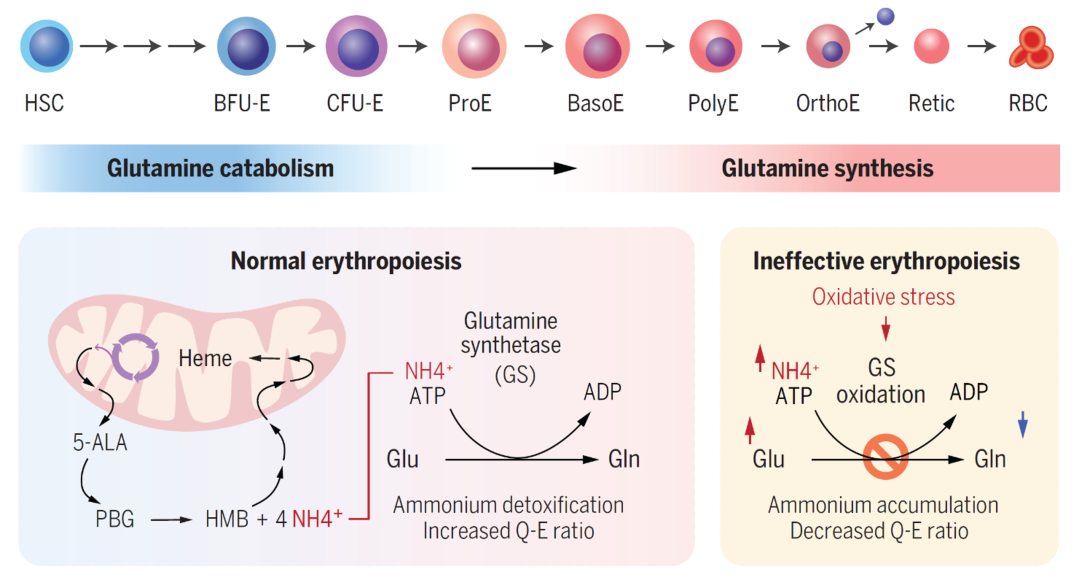
图1. 谷氨酰胺代谢转换在红细胞发育和疾病中的作用模式图
综上所述,在红细胞分化成熟过程中,谷氨酰胺合成酶的表达逐渐上调,催化谷氨酰胺分解的酶类逐渐下调,导致谷氨酰胺含量增加、谷氨酸含量减少。随着红细胞的分化成熟,血红素合成过程中会产生大量有毒的铵离子,而谷氨酰胺代谢转换能够增强谷氨酰胺合成酶的活性,加速催化谷氨酸和铵离子结合生成谷氨酰胺。这一代谢转换对于解毒血红素合成时产生的铵离子和促进红细胞的分化成熟至关重要(图1)。在β-地中海贫血的红系细胞中,过量的游离α-珠蛋白易发生沉淀和自氧化,由此产生的ROS、游离血红素和铁的累积会促使谷氨酰胺合成酶受氧化损伤,进而导致其活性受损,最终造成红系细胞中谷氨酸和铵离子的累积。铵离子的累积则进一步加剧氧化应激,损伤谷氨酰胺合成酶并降低谷氨酰胺合成,从而形成氧化应激损伤的恶性循环。通过抗氧化剂或蛋白过表达增强谷氨酰胺合成酶活性,可显著改善β-地中海贫血中受损的谷氨酰胺代谢和红系细胞成熟。因此,监测谷氨酰胺合成代谢水平,不仅可以评估红细胞分化成熟程度,还可作为评价相关疾病治疗过程中药物疗效的代谢标志物,为以代谢靶向的红细胞疾病治疗策略的开发提供了新思路。
美国圣裘德儿童医院徐剑教授和倪敏助理教授为该论文的共同通讯作者。徐剑教授团队的吕军华,顾志敏(西南医学中心,现为中国医学科学院系统医学研究院/苏州系统医学研究所研究员)和张元女为论文的并列第一作者。圣裘德儿童医院Mitchell J. Weiss课题组和西南医学中心Ralph J. DeBerardinis课题组为该研究提供了大力支持和帮助。
原文链接: https://doi.org/10.1126/science.adh9215
徐剑教授本科和硕士毕业于复旦大学,加州大学洛杉矶分校获博士学位,博士后师从哈佛医学院Dr. Stuart Orkin进行造血干细胞的表观遗传调控和BCL11A介导的血红珠蛋白基因调控机制的研究。研究成果以第一或共同第一作者发表在Nature和Science等期刊上。基于他们对血红珠蛋白基因调控机制的系列基础研究,CRISPR介导的BCL11A增强子基因治疗血红珠蛋白疾病(镰刀性贫血和地中海贫血)于2023年获得欧洲和美国FDA批准, 成为首个CRISPR技术应用于人类疾病的基因疗法。徐剑教授于2014年加入西南医学中心(UT Southwestern Medical Center)建立研究团队,2023年加入圣裘德儿童医院(St. Jude Children’s Research Hospital),主要从事肿瘤基因组学,基因表达调控,表观遗传学和肿瘤代谢的研究。近几年以通讯作者在Cell,Science,Cancer Discovery,Nature Cell Biology,Nature Genetics和 Nature Metabolism等期刊上发表多篇高水平研究论文。课题组培养的博士后在多个领域开展独立科研工作,团队诚邀优秀博士后加盟,欢迎联系(www.stjude.org/xu-j)
1. Orkin, S.H. and L.I. Zon, Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 2008. 132(4): p. 631-44.2. Palis, J., Ontogeny of erythropoiesis. Curr Opin Hematol, 2008. 15(3): p. 155-61.3. Kumada, Y., et al., Evolution of the glutamine synthetase gene, one of the oldest existing and functioning genes. Proc Natl Acad Sci U S A, 1993. 90(7): p. 3009-13.4. Pesole, G., et al., Glutamine synthetase gene evolution: a good molecular clock. Proc Natl Acad Sci U S A, 1991. 88(2): p. 522-6.5. Dimski, D.S., Ammonia metabolism and the urea cycle: function and clinical implications. J Vet Intern Med, 1994. 8(2): p. 73-8.6. Spinelli, J.B., et al., Metabolic recycling of ammonia via glutamate dehydrogenase supports breast cancer biomass. Science, 2017. 358(6365): p. 941-946.

转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。















