
随着骨组织工程的发展,用于骨缺损修复的3D打印HA/PCL支架已被广泛研究。然而,目前对3D打印纤维走向同时调节干细胞和巨噬细胞的情况研究较少。
广东省科学院生物医学与工程研究所许为康团队和遵义医科大学附属第二医院瓦庆德团队
应用3D打印技术构建多角度纤维走向的仿生三维HA/PCL支架,评估不同纤维走向对支架理化性能、成骨成血管以及免疫调节方面的影响
。

1、主要内容
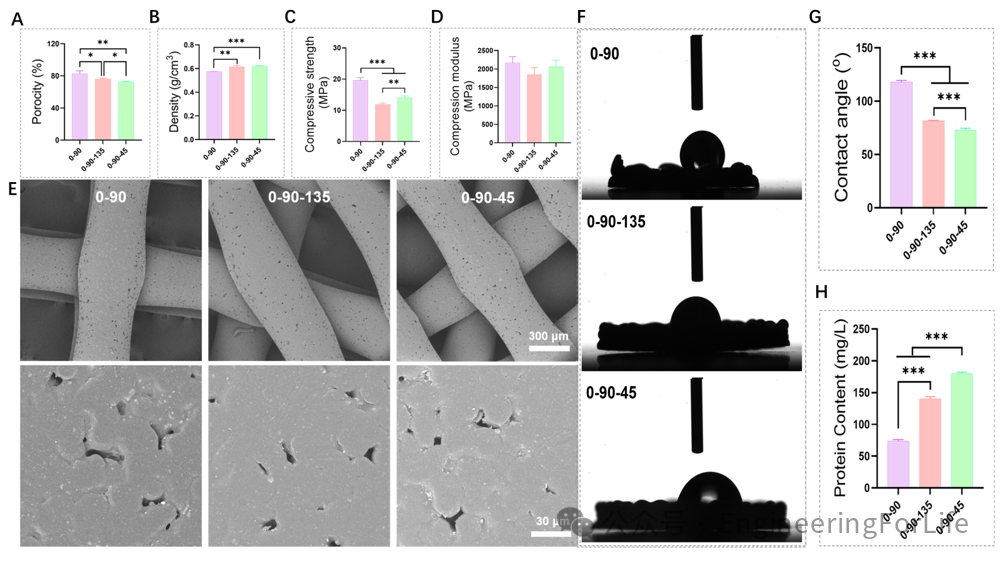
图 1 0-90、0-90-135和0-90-45支架的理化性能
0-90组纤维呈90°交叉,0-90-135组是在此基础上增加了一条135°的纤维,而将0-90-135组原有交叉旋转45°则得到了0-90-45。从高倍镜下看,支架表面均散在分布HA颗粒,这些颗粒增加了表面的粗糙度,利于细胞粘附。
纤维走向的不同影响了支架的理化性能。
0-90、0-90-135和0-90-45的孔隙率逐渐下降
。纤维夹角的不同在降低孔隙率的同时增加了支架的密度。在抗压性能方面,以
0-90组最显著,最低的是0-90-135组。支架的亲水性随着纤维走向复杂程度的增加而提升,而这也与支架的蛋白吸附性能趋势一致,0-90-45吸附BSA的能力最显著,最低的是0-90组。
这可能是0-90纤维受力方向统一且较均匀,0-90-135的135°走向纤维改变了原有的受力结构,而0-90-45密度高于0-90-135,因此抗压强度更为显著。此外,更复杂的纤维走向导致了单位面积内的纤维数量增多,更利于蛋白和细胞的粘附。
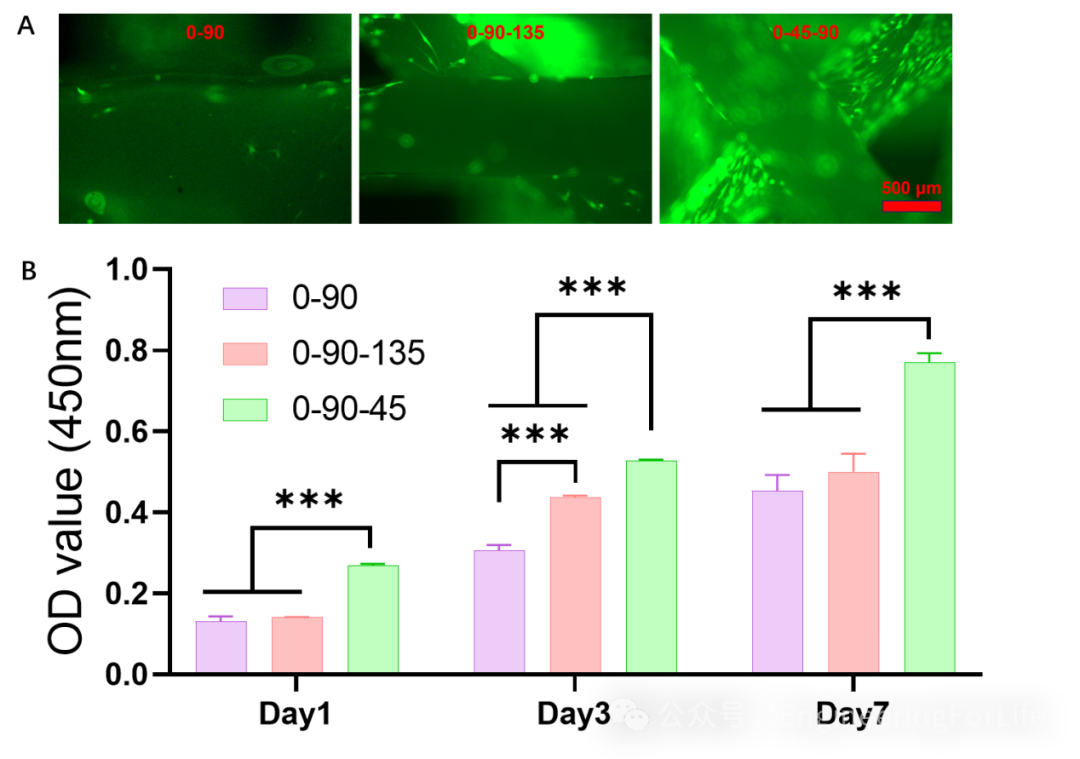
图2 不同纤维走向支架上BMSCs的活细胞染色和增殖
骨髓间充质干细胞(BMSCs)与支架共培养第1天,
0-90-45组的OD值显著高于其他组
,而其余两组差异不显著。在第3天,BMSCs的增殖活性呈0-90-45、0-09-135、0-90的趋势递减。这趋势与第3天的活细胞染色一致,BMSCs显著粘附于0-90-45组,呈现最强的荧光。各组支架的细胞增殖均随培养时间的增加而增加,0-90-45组在第7天仍明显优于其他组。
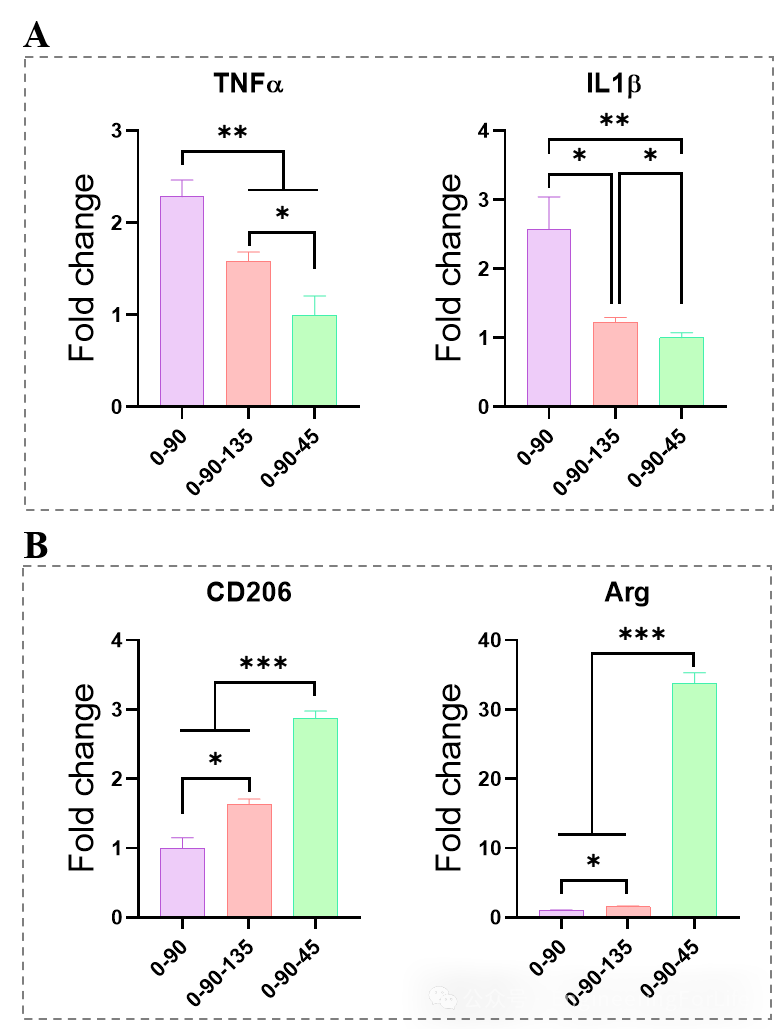
图3 0-90、0-90-135和0-90-45调控巨噬细胞极化性能差异
整体上看,0-90组促巨噬细胞(MPs)M1型基因(TNF-α、IL-1β)的表达上调最为显著,
相比于其他组,0-90-45组促炎基因的表达明显下调
。
在巨噬细胞M2型基因的表达中,
0-90-45组的CD206和ARG表达显著上调
,呈现0-90、0-90-135、0-90-45的趋势递增。
我们推测,小角度的纤维夹角使得MPs充分拉伸,而MPs的拉伸程度与M2表型标记物的表达相关。
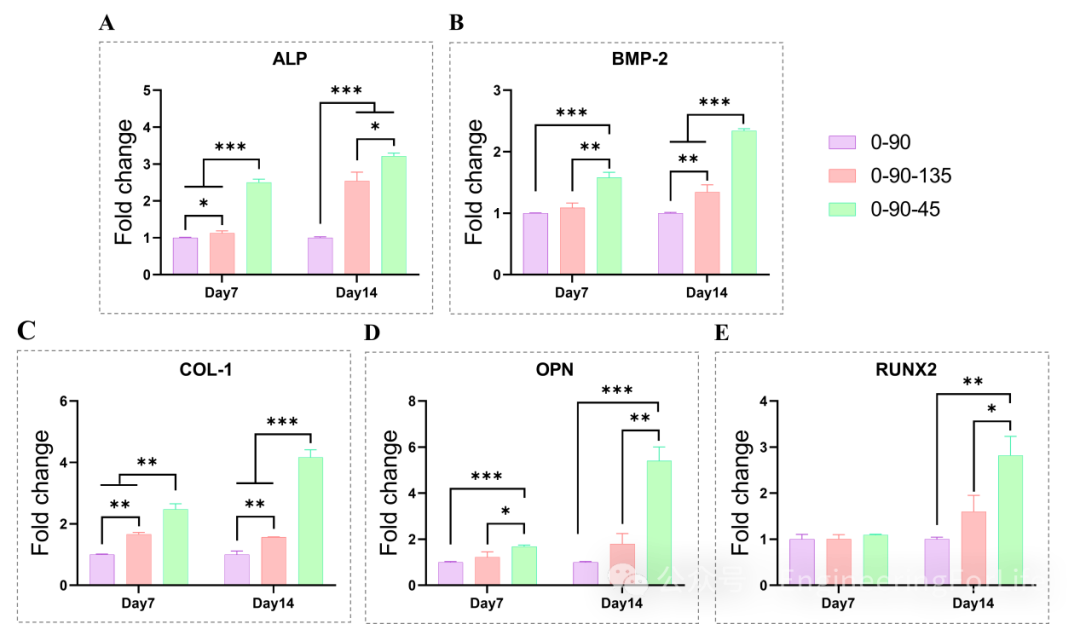
图4 0-90、0-90-135和0-90-45与BMSCs共培养第7和14天的成骨基因(ALP、RUNX2、OPN、COLI、BMP-2)表达

图5 支架与BMSCs共培养7天的ALP染色和定量分析
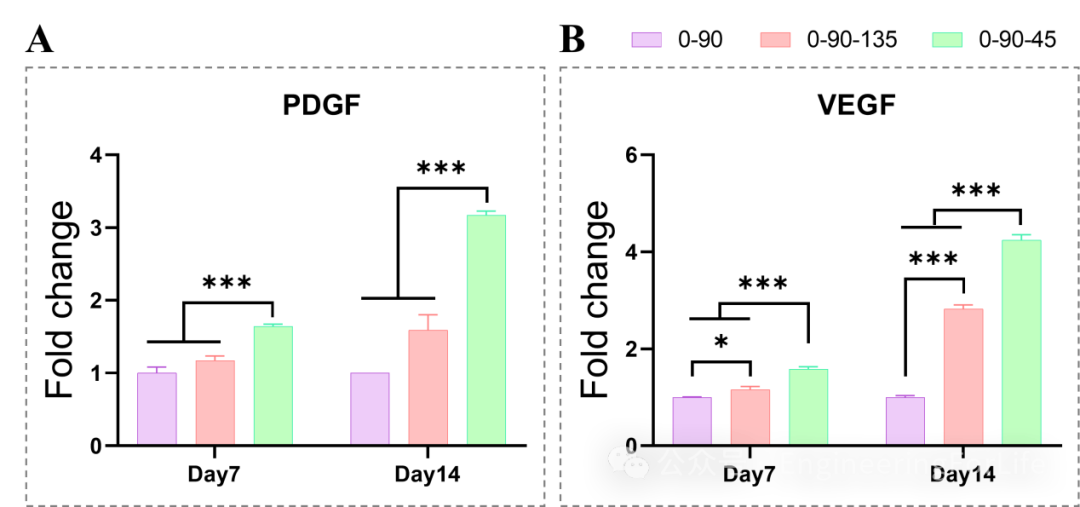
共培养第7和14天的成血管基因PDGF和VEGF的表达
在成骨分化过程中,除了第7天时三组支架在RUNX2的表达上无显著差异,其余情况下,0-90-45促相关成骨基因表达均显著高于其他两组。而0-90-135组则是普遍优于0-90组。成骨诱导的第7天进行ALP定量分析,0-90-45组ALP表达量最高,其次是0-90-135组,最低的是0-90组,这也与ALP染色结果一致。在成血管因子基因(PDGF、VEGF)的表达展示在图6,0-90-45组在各个时间点均显著优于其余两组。在PDGF表达中,0-90与0-90-135两组无显著差异,而相比0-90组,0-90-135显著上调VEGF的表达。
总体来说,在促BMSCs成骨分化和成血管性能方面,0-90<0-90-135<0-90-45。研究表明,支架表面高曲率或纤维夹角小会增加BMSCs的张力并促进其分化
。
此外,在孔径较小的支架中,倾向于细胞生长而不是细胞外基质的分泌。相比其他组,0-90-45组的表面曲率更高、纤维夹角小且孔径较小,因此表现出显著的促BMSCs分化性能。这可能也是多角度交错的纤维能更好的模仿松质骨的生理结构,支架处于理化性能、细胞粘附和营养物质交换之间最佳的平衡状态。
2、总结与展望
本研究制备出不同纤维交叉(走向)的HA/PCL支架(0-90、0-90-135、0-90-45),旨在模拟骨松质的三维结构。结果显示,多角度交错的纤维影响支架整体的孔隙率和抗压强度。
相比其他两组,0-90-45支架能够诱导MPs向M2表型极化形成利于成骨的免疫微环境,同时具备最显著的成骨成血管潜能
。
总之,仿生性是支架的生命,本研究对骨组织工程支架的探索又向前迈进了一步。
参考资料:
https://doi.org/10.1371/journal.pone.0314150
来源:
EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






