一致性评价有望再次加速。
今日,国家食药监总局发布公告,又有149家医院获得药物临床实验机构的认定。

分析人士指出,大规模增加临床实验机构将大大缓解目前机构短缺的问题,加速企业临床实验进程,降低企业的成本。
机构短缺:有企业垄断临床,也有企业出国求助
2016年的3月5日,国务院办公厅下发《关于开展仿制药质量和疗效一致性评价的意见》,要求化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。
国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
由于,有不予注册等强制性条款,一致性评价成了不少企业的头等大事。但是,临床实验机构短缺成了行业普遍吐槽的问题。
根据国家食药监局的公告,首批需要在2018年底前完成一致性评价共涉及292个基本药物目录品种,据丁香园旗下Insight数据统计,共涉及19715个批准文号,其中可以确定的有效批文为70.34%;涉及企业数量为2028家。
截止2015年底,全国共有433家GCP证书未到期,而根据CDE临床试验登记平台和中国临床试验注册中心ChiCTR数据,只有122家开展过BE/I期项目。此前2016年1月,业界曾有一项调研显示,400余家临床试验机构中仅有53家机构表示愿意承接BE/I期项目。
临床机构短缺带来的直接结果是,BE临床试验费用直线飙升。据上证报调研,以前做一个产品需要花费30万至40万元,现在已提高到了250万至400万左右,而临床试验费用也将翻番,例如普通三类药从过去的300万元左右涨到了现在的600万至700万元。
在价格攀升的同时,药企还开展了临床实验资格争夺大战,此前有业内人士对健识君表示,有药企直接和医院、临床实验机构约定,该医院只承接该企业临床试验,保证企业研发进展的同时也提高了其竞争优势。也有企业选择到国外做临床。
分析人士指出,大规模增加临床实验机构将大大缓解目前机构短缺的问题,加速企业临床实验进程,降低企业的成本。
药企仍需要足够理由说服机构
虽然临床实验机构数量增加,不过,分析人士指出,一方面是临床试验机构将会更慎重地选择承接的试验项目;另一方面,对于接下来的项目将会认真对待,保证试验质量。
以前由于临床试验多、机构少,机构处于相对强势的一方。企业虽然是临床实验的申办方,肩负监督和管理项目的职责,但在实际工作中,往往无法真正监督临床试验机构的工作;临床试验机构由于同时承接多个项目,受试者和研究者的数量常常不能满足项目需要,这也是造成试验中存在一些问题的原因之一。
2015年7月22日,国家食药监开始临床实验的自查和核查,截止到2016年1月5日,列入自查和核查的1622个品种,主动撤回和不予通过的比例已经超过八成。而在这次常自查、核查风暴中,有多家临床机构涉嫌造假被立案。
2017年4月10日,最高人民法院审判委员会全体会议,审议并原则通过《最高人民法院、最高人民检察院关于办理药品、医疗器械注册申请数据造假刑事案件适用法律若干问题的解释》(以下简称《解释》),《解释》明确,对于药品注册申请人自己弄虚作假,提供虚假的非临床研究或者临床试验报告及相关材料,骗取药品批准证明文件的,可以按生产、销售假药罪定罪处罚。《解释》进一步增强了对临床实验造假的震慑力。
业内人士表示,临床试验机构虽然在不断增加,但是在对临床试验常态化的严监管下,临床实验机构在选择项目上会更加谨慎,这对企业——临床申办方提出了更高的要求:在临床试验开始之前,企业仍需要提供足够多的资料和数据支持该临床试验的必要性和可行性,才能说服临床试验机构和研究者接下这个项目。
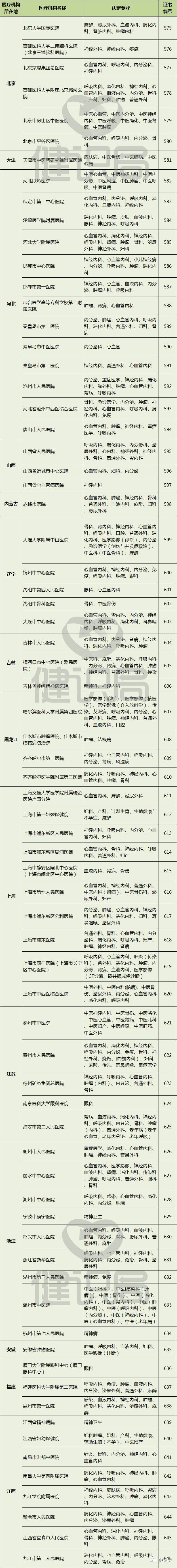
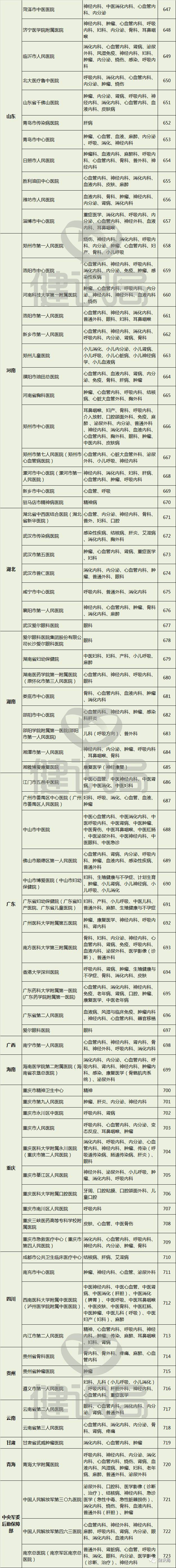
附:149家具有药物临床试验机构资格的医疗机构名单
本文源自微信公众号健识局,转载本文仅为学习与交流,如无意中冒犯到版权请联系小编删除。















