“
ER
、
PR
、
HER2
的表达是目前临床乳腺癌治疗的靶点,
三阴性乳腺癌(
TNBC
)
患者因为缺少这些靶点,不能从内分泌治疗以及靶向治疗中获益,中位生存期仅为
20
个月左右。
TNBC
因其预后差、复发转移率高、死亡率高而成为乳腺癌治疗研究的难点和重点。
幸运的是,越来越多的证据表明
TNBC
独特的特征使其对免疫治疗反应性更好。
TNBC
突变率高,产生的肿瘤抗原也高,肿瘤浸润性淋巴细胞也多,这些都能诱导免疫应答。
然而,
"claudin-low"
亚型的乳腺癌患者却对
IO
治疗无效,虽然其肿瘤微环境中也含有大量免疫细胞。”
近
期,
UNC Lineberger Comprehensive
癌症中心的研究者发现了
"claudin-low"
亚型乳腺癌对免疫治疗无应答的可能原因及解决方法。文章发表于最新一期的
Journal of Clinical Investigation上。
"claudin-low"
亚型乳腺癌的肿瘤内和周围微环境中聚集了大量免疫细胞,按照
IO
治疗的理论,免疫细胞聚集肿瘤周边,
如果用免疫检查点抑制剂放开免疫系统“刹车”,应该有助于机体对抗癌症。然而,现实中治疗效果却恰恰相反:解除免疫系统抑制的免疫检查点抑制剂对此类亚型无效。
为此,研究者决定从基因组水平(而不是笼统的免疫细胞的数量和浓度)分析这些免疫细胞的亚型,结果发现,
claudin-low
型肿瘤周围有着高浓度的调节性
T
细胞(
Treg
),
Treg
细胞发挥着免疫负调控作用,会抑制机体的防御功能。进一步研究发现,
claudin-low
肿瘤会释放化学信号吸引这些
Treg
细胞。
UNC
医学院助理教授,
UNC Lineberger
的
BenjaminVincent
博士说到:“这种调节性
T
细胞会阻止免疫系统排斥肿瘤。”我们认为如果能去除这些细胞,就能帮助免疫系统更好的对抗乳腺癌细胞。
为了验证这一想法,研究者分别构建了
DTR
(白喉毒素受体)敲入的转基因小鼠模型(
DEREG
小鼠)和带瘤的野生型非转基因野生型肿瘤小鼠模型来测试消除
Treg
细胞对肿瘤小鼠模型的影响。白喉毒素(
DT
)能特异性的消除小鼠体内的
Treg
细胞,而环磷酰胺(
Cy
)治疗能选择性的消除
Treg
细胞,
结果发现:与
DT
治疗
DEREG
小鼠类似,低剂量(
100mg/kg
)
Cy
治疗也能显著延缓肿瘤生长,但是最终小鼠仍然会死于肿瘤进展或是自身免疫病(
DT
治疗组)
(见图
1A
、图
1B
)
,这表明消除
Treg
能延缓肿瘤生长,但无法控制肿瘤
。紧接着,研究者又分别用
IO
药物单独治疗和联合
DT
治疗肿瘤模型小鼠,
结果发现:联合治疗能显著提高小鼠生存期,肿瘤大小也有大幅缩小(见图
2A
、图
2B
)
。据此,研究者认为他们找到了阻止免疫治疗作用的关键环节。
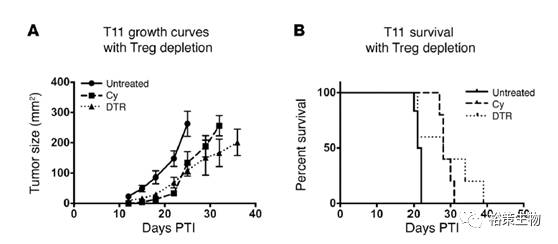
图
1
消除
Treg
延缓过继免疫系统缺失小鼠体内的肿瘤生长
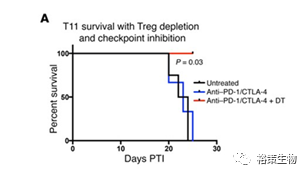
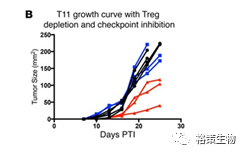
图
2
消除
Treg+PD-1/CTLA-4
治疗显著延缓肿瘤生长
这一结果在某种程度上阐明为何免疫治疗的应答率在三阴性乳腺癌中低的原因。我们正在找寻那些不应答的患者不应答的原因,而我们又可以做什么来使他们的肿瘤对免疫治疗产生应答。
Vincent
正在带头展开一项临床研究来测试这种方法是否能改善免疫检查点抑制剂的应答。研究者认为该项结果也需要在其他类型的癌症中在基因组水平上
展开研究,来理解免疫治疗应答率的差异。
参考文献:
1,https://medicalxpress.com/news/2017-08-immune-cells-contribute-treatment-resistance.html
2
,
Nicholas A. Taylor et al, Treg depletion potentiates checkpoint inhibition in claudin-low breast cancer,
Journal of Clinical Investigation
(2017).——“
公众号留言 Treg可获取文献
”





