

细胞代谢组学通常被定义为胞内和细胞膜小分子代谢物的集合,它可鉴定生化反应的产物
-
内源性小分子,揭示一个活细胞中所运转的不同通路之间的联系
[1-2]
,并可揭露和评价健康和病理机体之间的生化差异
[3-5]
,反过来可为药物干预提供一个方向。代谢物参与胞内进程的多种变化,其浓度可近似地反映一个器官、组织或细胞的表型。细胞代谢组学分析可定性、定量地描述胞内调控的最终产物,这些产物是生物系统对遗传因素或外界环境改变的最终应答
[6]
。细胞代谢组学研究表明,在强大的细胞代谢网络中,生化途径的能动行为可由一个高度互联的调节系统来控制
[7]
。目前细胞代谢组学已经在多种领域中得到应用,如疾病诊断、毒性评价、药物作用机制、新药研究、细胞培养监测、食品组学等
[8]
。在后基因组时代,与其他方法相比,体外细胞代谢组学表现出了更多的优势,如容易控制实验变化、高度重现性、低成本、结果更易解释等,除了肝细胞的原代培养外,年龄、性别、跨学科变化、种群控制等因素在体外细胞研究中都不是主要影响因素
[6]
。细胞代谢组学是一个新兴发展的领域,它可解决基本的生物学问题,并允许观察细胞内的代谢现象。其作为系统生物学的一个重要分支近年来受到广泛的关注。
糖尿病(
diabetes mellitus
,
DM
)以高血糖为主要特征,成为继肿瘤、心血管疾病之后第
3
大严重威胁人类健康的慢性内分泌代谢性疾病
[9]
。研究发现,在糖尿病发生及糖尿病血管病变过程中,晚期糖基化终末产物(
AGEs
)起到了关键性的作用
[10]
。糖尿病血管病变发生最基本的是血管内皮细胞(
VEC
)结构和功能的受损,持续的高血糖导致内皮细胞损伤及功能紊乱,增高血管内皮通透性,还可抑制内皮细胞的迁移、增殖
[11]
。
山茱萸环烯醚萜苷类特征成分莫诺苷能明显抑制糖尿病大鼠肾皮质内皮细胞增生,减轻内皮细胞的肿胀程度,降低内皮细胞间通透性,保护内皮的完整,对糖尿病血管并发症内皮细胞具有明显的保护作用
[12-13]
。因此,本实验采用超高效液相色谱
-
串联四极杆飞行时间质谱(
UPLC-Q-TOF/MS
)技术并结合主成分分析(
PCA
)、偏最小二乘法
-
判别分析(
PLS-DA
)和正交偏最小方差判别分析(
OPLS- DA
)方法
[14-15]
,对各组细胞中的内源性代谢物变化进行分析辨识,寻找各组细胞潜在标志物,通过独特通路分析(
IPA
)构建代谢组学特征网络图,探寻了
AGEs
诱导损伤
HUVECs
的原因及莫诺苷保护血管内皮细胞的作用机制。
1
实验材料
1.1
细胞株
人脐静脉内皮细胞株(
human umbilical vein endothelial cells
,
HUVECs
)购自上海汉博生物科技有限公司。
1.2
试药与试剂
莫诺苷(
morroniside
),批号
111998-201602
,购于中国食品药品检定研究院,质量分数≥
98%
;
RPMI 1640
培养液、胰蛋白酶(
Trypsin
),美国
Gibco
公司;胎牛血清(
FBS
),杭州四季青公司;磷酸缓冲盐(
PBS
),博士微生物工程有限公司;二甲基亚砜(
DMSO
,细胞级),美国
Sigma
公司;乙腈、甲醇,色谱纯,德国默克公司;甲酸,色谱纯,美国
Tedia
公司;超纯水由
Milli-Q
系统制,美国
Millipore
公司。
1.3
仪器
Synergy HT
酶标仪,美国
Bio-Tek
公司;
CO
2
恒温干燥箱,
SANYOA
公司;
SWCJ-1F
型双人超净工作台,苏州净化设备有限公司;
Ti
型倒置荧光显微镜,上海光学仪器一厂;
KQ-500B
超声波清洗器,昆山和创仪器有限公司;
−80
℃超低温冰箱,美国
NuAire
公司;
Avanti J-25
高速冷冻离心机,德国
Beckman
公司;
XW-80
型旋涡混合器,上海医大仪器厂;
AcquityTM UPLC
液相色谱仪,
Waters
公司;氮气吹干仪,无锡沃信仪器有限公司;
Synapt
TM
Q-TOF
质谱仪,
Waters
公司,配有
Lock-spray
接口,电喷雾离子源(
ESI
);
Masslynx 4.1
质谱工作站软件,
Metabolynx
,
Waters
公司。
2
实验方法
2.1
AGEs
的制备
[16]
将牛血清白蛋白(
BSA
)在
0.2 mol/L
磷酸盐缓冲液(
PBS
,
pH 7.4
)中配制成
50 g/L
,同时将葡萄糖在上述液体中配制成
0.5 mol/L
,充分溶解,
37
℃避光孵育
3
个月,使其形成
AGEs-BSA
。同时,平行条件下配制不加入葡萄糖的上述
BSA
溶液,以制备无糖基化
BSA
(
0-BSA
)作为对照。待
AGEs
形成后,用孔径为相对分子质量
10000
的透析袋低温透析
24 h
,除去未反应的葡萄糖。用
0.22 μm
过滤器滤过除菌后保存于
−20
℃备用。
2.2
细胞培养及分组
HUVECs
采用
10% FBS RPMI 1640
培养液培养,按
1
∶
3
比例进行传代培养,每
2
~
3
天换液
1
次,传代至第
5
~
7
代的细胞用于实验。
取对数生长期的分化成熟细胞,用含
0.02% EDTA
的
0.25%
胰酶消化后制成细胞悬液,接种于
6
孔板,每孔
100 μL
,于
37
℃、
5% CO
2
培养箱中静置培养
24 h
。当细胞贴壁生长至
80%
~
90%
融合状态时,换无
FBS RPMI 1640
培养液饥饿培养
23 h
,加入莫诺苷溶液(终浓度为
10μmol/L
[17]
)预孵
1 h
后,加入终质量浓度为
200 mg/L
的
AGEs
刺激,同时设模型组(
200mg/L AGEs
)和对照组。每组设
6
个复孔。孵育
24 h
后,收集细胞。
2.3
样品处理
[2]
弃掉培养液后,用
50 mmol/L PBS
缓冲液淋洗
3
次,用细胞刮轻轻刮取细胞样品,以
1 000 r/min
离心
5 min
,弃去上清,获得细胞饼。在其中加入
−20
℃的
60%
甲醇
500 μL
,涡旋混合
30 s
,于
−80
℃冰箱
30 min
,淬灭细胞。取出融化后,超声破碎
10 min
,于
4
℃
、
13 000 r/min
离心
10 min
,取上清液;残渣加入
−20
℃的
60%
甲醇
500 μL
,重复上述步骤,两次上清液合并;在
40
℃加热条件下,氮气吹干,用
200μL 50%
乙腈复溶,于
4
℃
13 000 r/min
离心
5 min
取上清,将各组样品转移至进样瓶,编号,以备分析。
2.4
分析条件
2.4.1
色谱条件
色谱柱为
HALO C
18
柱(
100 mm
×
2.1 mm
,
1.7 μm
);体积流量
0.4 mL/min
;柱温
40
℃;样品室温度保持为
4
℃;进样量
10 μL
;流动相为
0.1%
甲酸水溶液(
A
)
-0.1%
甲酸乙腈溶液(
B
);梯度洗脱程序:
0
~
1 min
,
5% B
;
1
~
10 min
,
5%
~
95% B
;
10
~
12 min
,
95%
~
5% B
;
12
~
15 min
,
5% B
。
2.4.2
质谱条件
扫描方式为
ESI
正离子模式,脱溶剂气为
500 L/h
,脱溶剂气温度
300
℃,锥孔气为
50 L/h
,源温为
110
℃,毛细管电压
2 500 V
,锥孔电压
50 V
,微通道板电压为
2 500 V
,每
0.4
秒采集
1
次谱图;校正液为芦丁溶液,质量扫描范围
m
/
z
100
~
1 000
。采集方式为
centroid
,所采集在
Lockspray
下完成以确保数据的准确性和重现性,
Lockspray
频率为
10 s
。
2.5
数据分析
按上述分析条件对所有样品进行数据采集。数据导入
MarkerLynx 4.1
软件进行色谱峰识别及峰匹配,并采用无监督的
PCA
法和有监督的
PLS-DA
与
OPLS-DA
来区分组间代谢轮廓的差异。多变量统计分析采用
SPSS 16.0
分析软件,两组间比较采用
t
检验。
3
实验结果
3.1
各组细胞代谢物的典型色谱图
采用“
2.4.1
”项色谱条件,分别对各组细胞样品进
UPLC/Q-TOF-MS
正离子模式下的分离检测,对照组、模型组、给药组细胞典型基于峰值强度
(
BPI
)的色谱图如图
1
所示。可以看出对照组和模型组的
BPI
图在同一保留时间段色谱峰大小、高低表达均有一定差异,说明造模后的细胞内代谢物发生了变化;同样模型组与给药组的
BPI
图也有所差异,表明莫诺苷对
AGEs
诱导损伤的
HUVECs
内源性代谢物有一定的影响。

3.2
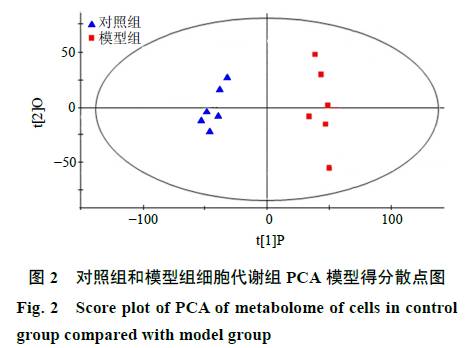
模式识别分析
采用
PCA
方法对对照组和模型组进行分析得到
1
个拥有
3
个主成分的
PCA
模型,
PCA
得分图中,对照组与模型组明显地聚为
2
类,提示
2
组间的细胞代谢表型存在显著差异(图
2
)。
为了使组间差异最大化,采用
PLS-DA
模型分析,并加入
OSC
信号校正。采用
OPLS-DA
法对对照组、模型组和给药组的代谢组学数据进行模式识别分析,通过样品得分图(图
3-A
)可看出,模型组位于椭圆内右上侧,与对照组、给药组较好地分开,并且组内样本点聚集较好,说明这
3
组细胞生理代谢状况存在明显的差异;给药组各样本在对照组与模型组之间,与模型组较好地区分,说明给予
莫诺苷处理后能使
AGEs
损伤的细胞代谢趋近正常细胞。
PLS-DA
模型是一种有监督的预测模型,在处理高维数据很容易出现过拟合现象,为防止模型过度拟合,验证模型可靠性,进行外部模型验证
[18]
。在建立的模型中,原始值
R
Y
2
=
0.956
、
Q
2
=
0.871
,
R
2
、
Q
2
的截距分别为
R
2
=(
0
,
0.327
),
Q
2
=(
0
,
−0.412
)(图
3-B
),
Q
2
在纵轴上的截距为负值,且最右端的
2
个值差距小,说明实验所建立的模型未发生过拟合,证明模型有效,可进一步分析。

3.3
潜在生物标志物分析
首先对模型组与对照对照组构建
OPLS-DA
模型,得到
S-Plot
图。在
S-Plot
图(图
4
)中,“
S
”曲线上离原点越远的点
VIP
值越大,对分类贡献也
越大。选择
VIP
>
1
的变量,进而对这些
VIP
值较大的变量作
t
检验,描绘出变量在各组的变化轨迹,筛选出潜在生物标志物。

对筛选出的潜在标志物所对应的高分辨质谱离子相对分子质量在
Human Metabolome Database
(
http://www.hmdb.ca/
)、
METLIN
(
http://www.metlin.scipps.edu/
)、
KEGG
(
http://www.genome.jp/kegg/
)、
SMPD
(
http://www.smpdb.ca/
)数据库中进行检索,
HMDB
数据库搜索匹配标准是准分子峰精确相对分子质量一致,即实测精确相对分子质量与数据库记载差异不大于
0.01
[19]
。在相应的保留时间下找到该代谢峰,同时结合二级质谱并参照有关文献来解析化合物。二级质谱碎片信息在
MassBank
(
http:// www.massbank.jp/
)、
ChemSpider
(
http://www. chemspider.com
)、
MetFrag
(
http://msbi.ipbhalle.de/ MetFrag/
)数据库中进行检索。
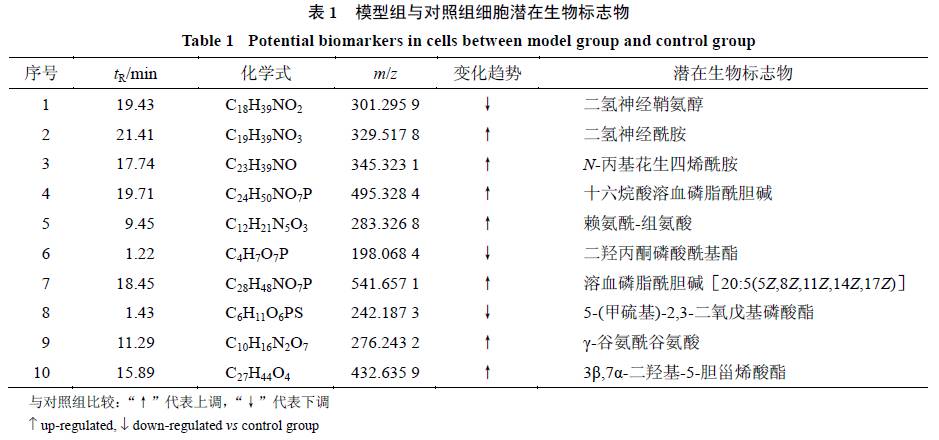
筛选出模型组与对照组有统计学意义的差异化合物
30
个,共鉴定出
10
个,见表
1
。由表
1
可见,与对照组细胞相比,模型组细胞中的二氢神经鞘氨醇、二羟丙酮磷酸酰基酯、
5-(
甲硫基
)-2,3-
二氧戊基磷酸酯量显著降低,二氢神经酰胺、
N
-
丙基花生四烯酰胺、十六烷酸溶血磷脂酰胆碱、赖氨酰
-
组氨酸、溶血磷脂酰胆碱
[
20:5(5
Z
,8
Z
,11
Z
,14
Z
,17
Z
)
]
、
γ-
谷氨酰谷氨酸、
3β,7α-
二羟基
-5-
胆甾烯酸酯的量升高。细胞中这
10
种内源性代谢物可能是
AGEs
诱导
HUVECs
损伤的潜在生物标志物,并且
10
种内源性代谢物在莫诺苷给药组均得到了不同程度的恢复。这
10
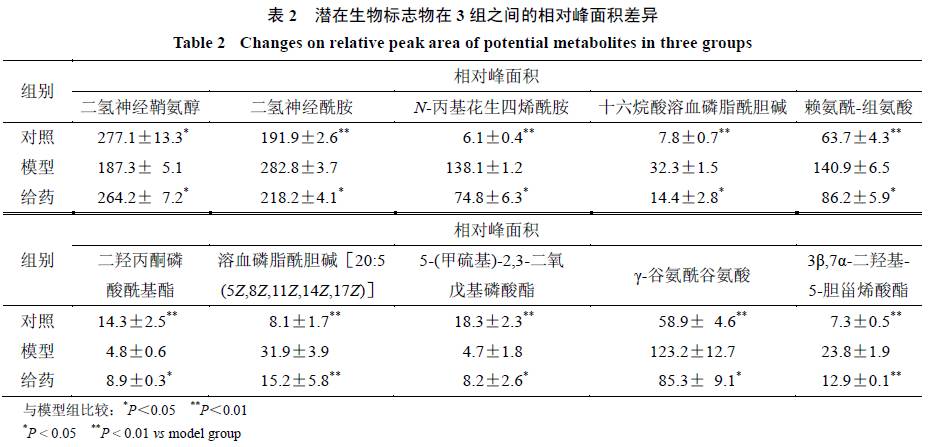
种潜在生物标志物在对照组、模型组和给药组细胞中的质量分数变化见表
2
。
3.4
潜在生物标志物生物学意义及代谢通路分析
鞘氨醇是一种鞘脂代谢物,是所有生物细胞膜的重要组成部分,具有高度的生物活性,在细胞增殖、分化、凋亡过程中发挥巨大作用
[20]
。它可通过抑制低密度脂蛋白诱导的胆固醇酯化来阻断胆固醇
运输,并使未酯化的胆固醇在核周囊泡周围积累。二氢鞘氨醇是神经酰胺的重要合成前体,神经酰胺是鞘磷脂代谢的合成前体,而鞘磷脂代谢失调可能导致细胞死亡
[21]
。
溶血磷脂酰胆碱(
LysoPC
)具有调节血管内皮一氧化氮合成酶和细胞质内磷脂酶
A
2
活化的作用,而内皮一氧化氮合成酶和细胞质内磷脂酶
A
2
是维持血管壁完整性、合成一氧化氮和花生四烯酸的重要因素,在人脐静脉内皮细胞中,溶血磷脂胆碱可降低组胺诱导的一氧化氮的释放
[22]
。由于花生四烯酸是磷脂酰胆碱经磷脂酶
A
2
作用后的产物,其量的变化与磷脂酰胆碱相同
[23]
。
氨基酸代谢是炎症和氧化还原反应的中心环节。组氨酸在机体进行脱羧形成的组胺是体内一种化学传导物质,具有抑制促炎性因子产生和产生抗炎性因子的作用
[24]
。
γ-
谷氨酰半胱氨酸是在谷氨酸代谢途径中主要作为谷胱甘肽合成酶。半胱氨酸(
Cys
)的过度堆积可促进细胞炎症的产生
[25-28]
,同时也增加心血管疾病风险
[29]
。
代谢通路分析使用
MetPA
数据库(
http://metpa.metabolomics.ca./MetPA/faces/Home.jsp
)搜索,其包含
KEGG
、
HMDB
数据库等信息,
KEGG
数据库为代谢物从代谢途径的水平理解细胞或组织的生物学意义提供了生物信息资源
[30]
。
MetPA
是一个免费的网络工具,它能够把强有力的通路分析与拓扑分析相结合,确定实验条件下最可能的相关通路。使用
MetPA
数据库筛选出
5
条代谢通路,分别是鞘脂代谢、甘油磷脂代谢、主要胆汁酸生物合成、醚脂代谢、半胱氨酸和蛋氨酸代谢(表
3
和图
5
)。结果显示这些内源性代谢物在实验过程中有明显的扰动,对细胞损伤有明显影响。独特的通路分析可以全局性地描绘生物化学的扰动以及细胞损伤的潜在机制。研究发现,莫诺苷可以影响上述通路。这些通路中,与
AGEs
诱导
HUVECs
损伤有关的生物标志物,大部分被调到接近对照组水平。


4
讨论
代谢组学是一个强有力的新技术,通过容易获得的生物体液来全面勾画代谢轮廓,通过生物标志
物的发现来区分疾病与非疾病状态
[31-33]
。在后基因时代,用代谢组学模式来筛选生物标志物和阐明生物化学过程随着系统生物学的发展同步增长
[34-35]
。因此,扰动一个有机体的生物过程能够导致它本来固定代谢物状态的明显改变,使得代谢组学成为一个多参数分析技术,这项技术能够得到与疾病关联的异常的代谢物。代谢物网络提供了一个统一的平台,通过这个平台,可以把代谢物与疾病的基因、蛋白、药物、药物靶点整合起来。
微生物代谢组学的研究对象,通常分为细胞内代谢产物和细胞外代谢产物。对于细胞外代谢产物的研究,又称为代谢足迹分析,即通过监测生物体在培养环境中消耗了什么和分泌了什么,从而得到不同生物体的代谢特征
[36]
。细胞内代谢产物通常被定义为胞内和细胞膜小分子代谢物的集合,揭示一个活细胞中所运转的不同通路之间的联系,包含了更丰富的代谢信息,能更精确地解释个别基因改变后的生物体变化等优点。细胞在进行生命活动的过程中时刻都需要进行物质交换,细胞从外环境中吸收营养物质等,排出代谢产物等
[37]
。而细胞内代谢产物种类与量的变化是生物系统对外界环境改变或遗传因素的最终反应,所以本研究选择
HUVECs
内代谢产物为细胞代谢组学的研究对象,通过代谢通路分析,探讨
AGEs
诱导损伤
HUVECs
的原因及莫诺苷保护血管内皮细胞的作用机制。
对模型组细胞潜在生物标志物进行大致的分类,主要有
6
类主要的物质:氨基酸类、溶血磷脂酰胆碱类、花生四烯酸类、磷酸酯类、鞘脂类、胆汁酸类。推测脂质代谢、氨基酸与胆汁酸代谢紊乱是
AGEs
诱导
HUVECs
损伤的主要原因。
从代谢通路分析,二氢神经鞘氨醇与二氢神经酰胺构建了鞘脂代谢,二羟丙酮磷酸酰基酯参与了甘油磷脂代谢、醚脂代谢,溶血磷脂酰胆碱
[
20:5 (5Z,8
Z
,11
Z
,14
Z
,17
Z
)
]
存在于甘油磷脂代谢通路,
5-(
甲硫基
)-2,3-
二氧戊基磷酸酯与
3β,7α-
二羟基
-5-
胆甾烯酸酯分别表达了半胱氨酸和蛋氨酸代谢、主要胆汁酸生物合成途径,提示鞘脂类、溶血磷脂酰胆碱类、磷酸酯类、氨基酸类与胆汁酸类代谢异常,造成了
AGEs
诱导
HUVECs
损伤
5
条代谢通路的
紊乱。
而鞘脂代谢通路影响值最高(
0.278 20
),鞘脂代谢异常可导致细胞生长抑制和失调
[38]
,产生多种疾病。神经鞘脂类是细胞膜的结构成分之一。其代谢产物如神经酰胺、鞘氨醇、
1-
磷酸鞘氨醇亦是具有生物活性的信号分子,可作为第
1
和(或)第
2
信使调控着细胞的生命活动,如细胞的增殖、存活、迁移、新生血管形成
[39]
。二氢神经鞘氨醇可分别在神经酰胺合酶,二氢神经酰胺氢酶作用下形成神经酰胺,而神经酰胺的积累能引起许多脂类代谢疾病。实验中发现,与对照组相比二氢神经鞘氨醇、二氢神经酰胺在模型组中的量显著降低、升高,这表明模型组细胞发生鞘脂代谢紊乱。给药组可以使二氢神经鞘氨醇、二氢神经酰胺水平分别显著升高、降低,这说明其有效地干预了细胞内的鞘脂代谢紊乱。
代谢网络图提供了一个解释代谢组学数据的最佳环境。经典的分析方法是强调能代表整体网络的代谢物。本研究的目的是把代谢组学作为一个揭示代谢通路的潜在工具,预测和发现病理与药物作用机制。本实验基于
UPLC/Q-TOF-MS
技术对细胞内源性成分进行分析,鉴定了
10
个潜在的生物标志物作用靶标,并预测了
AGEs
诱导
HUVECs
损伤的主要代谢网络。发现
5
条代谢通路,鉴定出的生物标志物均在这些代谢通路中,这些内源性物质在细胞内量的变化可能与
AGEs
所致
HUVECs
损伤有关,需要进一步验证。这些生物标志物在莫诺苷给药组细胞内有不同程度的回调作用。细胞代谢组学技术不仅可以帮助预测细胞炎症损伤疾病的发生,而且为监测疾病状态下体内代谢物的变化提供了一定的依据。
参考文献(略)
来 源:刘俊超,刘 丹,贾银芝,吴 云,王振中,萧 伟. 莫诺苷对晚期糖基化终末产物诱导人脐静脉内皮细胞损伤的代谢组学研究 [J]. 中草药, 2017, 48(13):2674-2681.






