近日,
JAMA Pediatrics
杂志发表了一篇名为《
Diagnostic Impact and Cost-effectiveness of Whole-Exome Sequencing forAmbulant Children With SuspectedMonogenic Conditions
》的文章(PMID:28759686),研究了全外显子测序(
Whole-Exome Sequencing
,
WES
)对疑似单基因病流动患儿的诊断价值和经济效益。课题组前期的一项试验,研究对象主要是小于
2
岁且怀疑有一种单基因病的婴幼儿,发现
WES
的阳性率
57%
,而常规辅助检查的诊断率仅为
13.5%
。在该研究中,课题组又对大年龄患儿进行了调查。
方法
:
研究对象是
2-18
岁疑诊单基因病的流动儿童,病人来源于
2015
年
5
月
1
日到
2015
年
11
月
30
日在澳大利亚墨尔本皇家儿童医院维多利亚临床遗传学服务中心就诊的门诊患儿。所有患儿至少有一个临床遗传学家的临床评估,由调查小组讨论每一个病例来确定纳入资格。纳入的患儿均是经过遗传学评估仍未临床确诊的典型病例,排除了通过临床评估即能确诊的病例,如软骨发育不全或
1
型神经纤维瘤病。研究对象均进行了非诊断性的
SNP
微阵列检查,但没做过任何单基因或
panel
测序,包括那些
WES
不能检测到的基因异常的患儿(如三核苷酸重复序列或甲基化),但排除了新表型的患儿。根据每个患儿的临床特征,课题组汇出与表型相关的候选基因列表进行优先分析,并通过数据库检索和团队讨论加以补充。
课题组进行了外显子测序、突变检测、过滤,平均覆盖度
147.5
,对
2015
年底前由
HUGO
基因委员会命名且与孟德尔病相关的
3203
个基因进行初步分析(根据墨尔本基因组变异数据库)。根据表型相关的候选基因列表和预测效果对突变进行排序。课题组只评估了与表型相关基因突变的致病性,最后对先证者及其父母进行
Sanger
测序验证。对疑诊病例的
WES
数据进行复查,以确定新发现的基因突变是引起患儿相关表型的原因。
成本计算
:
课题组收集了从起病到三级诊疗、首次临床遗传学评估、登记和
WES
报告的所有资料。所有住院和门诊病人的诊疗方案都是从病历中收集的,包括辅助检查、专家咨询,住院时间和差旅。最后统计住院、门诊专家预约、病例讨论、辅助检查的费用总和。
成本效益分析
课题组设想了
3
个假设方案和实际流程,并比较它们的成本和诊断率以对比哪种诊断流程最具性价比。(
1
)没有
WES
的标准诊断流程:包括所有用于诊断目的的辅助检查和临床评估。(
2
)做
WES
的标准诊断流程:包括所有上述的辅助检查和临床评估,且
WES
作为最后的检查。单人
WES
的费用由实验室支付,遗传服务模式包括由临床遗传学家和遗传顾问进行预测评估或遗传咨询,并出具结果,包括先证者及父母
Sanger
测序验证的费用。(
3
)是在第一次遗传学讨论中就进行
WES
:包括
WES
和第一次遗传学讨论的费用(测序,
Sanger
验证和遗传服务)。(
4
)是在首次三级诊疗时就优先考虑进行
WES
替代最初的三级评估和辅助检查:包括到三级医院初次就诊的费用和
WES
的费用(测序,
Sanger
验证和遗传服务)。
结果
44
名年龄
2-18
岁的患儿纳入试验,其中男
21
例(
48%
),女
23
例(
52%
);
30
人(
68%
)家住在离医院
80
公里以内,
14
人(
32%
)住得更远;最大的表型亚组是有多种先天性异常的(共
21
人
[48%]
)。任何患儿都没有接受过单基因或
panel
测序。使用
WES
的主要临床指征是诊断不明(
64%
)、遗传异质性(
32%
)、
2
种或以上的表型(
5%
)。
31/44
例(
70%
)患儿有智力或发育障碍,其中大多数智力障碍患儿伴有其他畸形,只有
7
人主要表现为智力障碍而无其他非特异性特征。
到三级诊疗中心看病的平均年龄为
28
个月,从起病到三级诊疗和遗传学评估的时间跨度为
13
个月。有
2
名患儿的产前超声检测异常,首次三级诊疗是出生时的儿科和遗传学评估,从同意做
WES
到出报告的平均时间为
181
天,大多数患儿(
37/44
例
[ 84% ]
)是由一般或专科儿科医师诊治,均查过非诊断性的染色体微阵列。所有发育或智力残疾的儿童都接受了脆性
X
综合征的检查。除了临床遗传学家外,每个患儿平均看过
4
个专家。
26/44
名儿童(
59%
)需要全身麻醉,
9
个孩子住院做了检查,其中
1
个孩子住了
2
次。
23/44
例(
52%
)的患儿经
WES
完成了分子诊断,其中
8
例(
35%
)患儿的致病基因不在基因列表中,大多数是新发杂合突变(
14/23
例
[61%]
),其中:常染色体隐性遗传(
6/23[26%]
)、
X-
连锁隐性遗传(
2/23[9%]
)和常染色体显性遗传(
1/23[4%]
)。
6/23
例(
26%
)患儿的治疗方案发生了改变,
1
例取消了额外的辅助检查,
1
例患儿的父母进行了产前植入前的基因诊断。
在这一研究中,包括
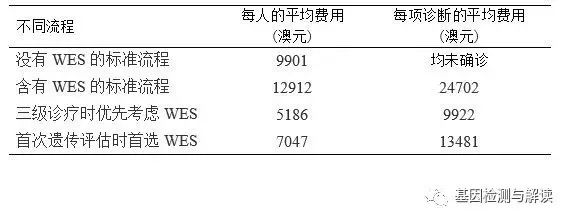
WES
在内的医疗支出总额为
568141
澳元,每人的平均费用和每项诊断的平均费用见下表,说明三级诊疗时优先考虑
WES
的费用最低,通过对各种诊断流程成本效益的比较,证实了在三级诊疗时优先考虑
WES
的流程比传统诊断流程更有性价比。
讨论
该研究证实了
WES
在一些有症候群症状儿童中的临床实用性,为早期使用
WES
提供了充分的证据。当怀疑遗传异质性或有多个表型时,应进行前瞻性的先证者
WES
。在亚组分析中,诊断率最低的是那些没有先天异常的智力残疾患儿(
14%
),家系
WES
在这些亚组中可能有更高的阳性率,一项回顾性队列研究发现,对于有神经发育障碍的患儿,家系
WES
的阳性率为
40%
。与诊断可疑的患儿相比(
39%
),怀疑有遗传异质性疾病患儿的诊断率较高(
86%
),但对于这些具有遗传异质性的患儿,靶向序列测序结合
MLPA
可能比
WES
的阳性率更高,但是
WES
可以多次分析新基因和孟德尔基因,很可能比逐个分析基因更划算。另外,
8/23
例(
35%
)患儿是由最初优先列表之外的基因突变导致的,这一发现可能不仅反映了医生临床知识的缺乏,但也强调了
WES
在实际诊断的作用。
WES
对治疗方案也有重要的临床意义,如
6/23
例(
26%
)改变了治疗方案,
1/23
例患儿停止了原本计划的检查,另
1
例患儿父母进行了产前植入前的基因诊断。治疗方案的变化包括并发症的监测,在确诊其他诊断时停止对可疑诊断的随访,以及对已知或正在发生的并发症进行专家评估。
该研究提示标准诊断流程的费用很高,早期应用
WES
可使成本效益最大化。对于具有复杂神经系统疾病的患儿,前期基因检测的费用占总费用的
43%
,即使没有前期基因检测的高费用,早期应用
WES
仍能使每个病人节约花费
9020
澳元,首次遗传学评估时查
WES
也比不查全外的标准诊断流程节省
5461
澳元。但课题组对费用的估算仍比较保守,因为不包括社区卫生人员进行的诊断检查费用。
使用家系
WES
可能提高阳性率,但其性价比仍有待确定,一项对
17
名先天性智力残疾儿童的回顾性研究发现,家系
WES
代替其他的基因检测和代谢筛查,可以节省大量的费用,但对其他临床表型的患儿,家系
WES
的经济效益仍有待进一步验证,同样,对于全基因组测序的临床价值和经济效益也需要进行类似的研究。
虽然该研究发现早期采用
WES
对有相关表型患儿的临床价值和性价比最高,但
WES
仍不能取代传统的辅助检查,且该试验的研究对象比较局限,所以在临床中仍应根据患儿不同的临床表现,制定个体化的遗传学检测策略。
译者介绍:

盛志强,山东省济宁市第一人民医院儿童康复科主治医师,硕士研究生,毕业于重庆医科大学儿科学院,致力于儿童生长发育和神经系统疾病的诊治。





