CRISPR-Cas9在全球各地的实验室中大放光彩,并且已经被应用到了临床上且证明了其威力。但CRISPR-Cas9有其局限性:上个月末Nature Methods上的一篇“Unexpected mutations after CRISPR–Cas9 editing in vivo”就指出了在全基因组测序研究中,CRISPR-Cas9编辑会令小鼠产生了上千个非目标基因突变,由此而引发关于这一技术精确性和安全性的一系列探讨。当然这篇文章并不是对CRISPR-Cas9技术的盖棺定论,但是一些科学家已经在寻找更为特异有效的新基因组编辑技术了。
2015年,麻省理工学院的张锋研究组发现CRISPR还有一个好朋友——Cpf1。CRISPR-Cpf1也能在crRNA的引导下在人类细胞中剪切目标DNA,被称为是新一代的CRISPR基因组编辑系统。今年张锋研究组在多篇发表于Nature
Biotechnology 上的文章中详细介绍了这种新系统。
从CRISPR-Cas9到CRISPR-Cpf1
CRISPR系统编码的RNA引导核酸内切酶对于细菌适应性免疫至关重要。CRISPR-associated
(Cas)核酸酶可以很容易被重编程来切割靶DNA序列,在各种生物体中实现基因组编辑。其中的一类核酸酶Cas9蛋白与两种短RNAs:crRNA和tracrRNA形成复合物。最常用的Cas9直系同源物SpCas9利用了在5′末端包含20个核苷酸(nt)与靶DNA位点“前间隔序列”(
protospacer)区域互补的crRNA。
crRNA和tracrRNA通常结合成大约100-nt的单导向RNA
(gRNA),指导SpCas9的DNA切割活性。有效地切割还要求SpCas9识别前间区序列邻近基序(protospacer adjacent
motif,PAM)。当前,研究人员已采用许多不同的方法确定了SpCas9核酸酶与不同gRNAs配对的全基因组特异性。并构建出了一些全基因组特异性显著增高的SpCas9变体。
同时科学家们也在不同类型的细菌中搜寻成百上千种的CRISPR系统,希望寻找具有一些有用的特性,可改造用于人类细胞的酶。结果来自氨基酸球菌属(Acidaminococcus)和毛螺菌科(Lachnospiraceae)的Cpf1酶成为了两个有前景的候选物,张锋等人在研究中证实了其可以靶向人类细胞的基因组位点。
不同于SpCas9,Cpf1只需要一个42-nt的crRNA,这一crRNA在它的3′端有23
nt与靶DNA序列的前间隔序列互补。此外,SpCas9识别的是前间隔序列3′端的NGG
PAM序列,而AsCpf1和LbCpf1识别的是前间隔序列5′端的TTTN
PAMs。早期的一些实验表明,可以重编程AsCpf1和LbCpf1核酸酶来编辑人类细胞中的靶位点,但只在少量位点对它们进行了测试,且尚未确定它们的全基因组特异性。
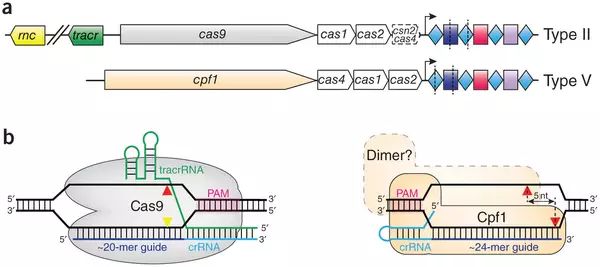 (Cas9,Cpf1及其各自的感染机制)
(Cas9,Cpf1及其各自的感染机制)
之后为了阐明Cpf1识别和切割靶DNA的机制,张锋研究组进行了深入探讨,2016年他们在Cell上发文,报告了氨基酸球菌属(Acidaminococcus
sp)Cpf1 (AsCpf1)与向导RNA和靶DNA复合物的晶体结构,分辨率达到2.8
埃(Å)。
AsCpf1采用了一种二裂片(bilobed)结构,RNA-DNA异源双链核酸分子束缚在中间通道内。他们通过比较AsCpf1和Cas9的结构,揭示出一些惊人的相似性和主要的差异,由此解释了它们独特的功能。AsCpf1包含RuvC结构域和一个推定的新核酸酶结构域,它们分别负责切割非靶向及靶向DNA链,由此生成交错的DNA双链断裂。AsCpf1借助了一些碱基和形状读取机制来识别5′-TTTN-3′PAM。
张锋《Cell》发表CRISPR研究新成果
之后他们同事证实两种Cpf1核酸酶AsCpf1和LbCpf1在人类细胞中的打靶效率与广泛使用的SpCas9相当。他们还证实利用来编程Cpf1核酸酶的crRNA
3′端有4-6个碱基对单碱基错配不敏感,而crRNA这一区域的许多其他碱基则对单碱基或双碱基替换高度敏感。针对两种Cpf1核酸酶采用GUIDE-seq测序方法和靶向深度测序分析,他们证实与20种不同的crRNAs配对一半以上的无法检测到脱靶切割。
CRISPR-Cpf1的新作用:多重基因编辑
过去用Cas9靶标多个基因组位点需要构建多个或者很大的表达载体,使这种基因组编辑技术受到一定的局限。研究人员发现,Cpf1能够加工自己的CRISPR
RNA
(crRNA)。而且Cpf1介导的pre-crRNA加工是独立于DNA剪切的。这种能力可以用来简化多重基因组编辑。张锋研究组在2016年年底设计CRISPR阵列,用一个载体同时在哺乳动物细胞编辑了四个基因,在小鼠大脑编辑了三个基因,初步进行了这方面的研究。
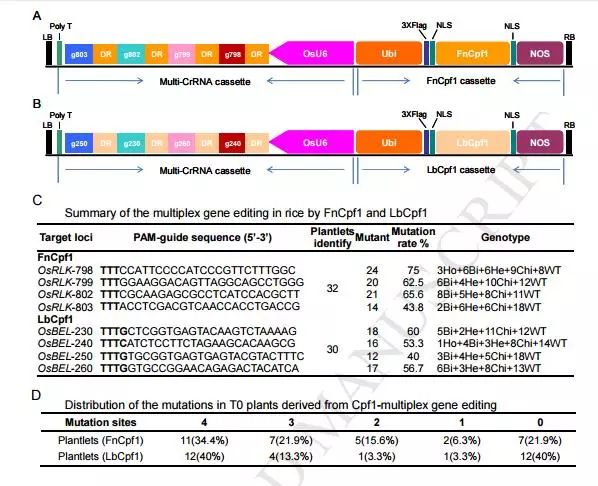
今年朱健康研究组利用Francisella novicida Cpf1 (FnCpf1)和 Lachnospiraceae bacterium
ND2006 Cpf1
(LbCpf1)对水稻进行单位点和多位点基因敲除的测试,研究表明上述两个Cpf1只需一条非常短的20-21bp的直接重复序列(direct repeats,
DR)加上22-24bp的靶位点识别序列(guide)即可实现单基因敲除,更重要的是,把多个DR-guide单元直接串联,只需要一个启动子驱动即可简单高效地实现多基因敲除。该研究利用4个DR-guide单元组成的CrRNA短阵列分别对水稻RLK和CYP81A家族的四个基因进行编辑,各位点的敲除效率达到40-75%。
这一系统简单、高效地在水稻中实现了多基因定点编辑,拓展了CRISPR系统在植物中的应用,为水稻基因组定点编辑提供了一个新利器。
为了详细介绍CRISPR-Cpf1的多重基因编辑作用,今年张锋研究组在Nature
Biotechnology杂志上发文,证明Cpf1在体外和哺乳动物细胞中最多能够切割4个crRNA的阵列(Array)。这样,单个启动子就能驱动crRNA阵列的表达,而不需要表达其他的核酸酶,如Csy4。
在张锋实验室的大多数实验中,他们使用了共表达Cpf1和crRNA阵列的单个载体。当表达crRNA阵列、Cpf1和GFP标签的单个质粒转染时,6.4%的HEK293T细胞实现了4个目标的编辑。不过,若转染多个质粒,其中每个质粒表达一个crRNA,再加上一个Cpf1表达载体,4重编辑的细胞仅为2.4
%。
如何利用CRISPR/Cpf1系统实现多重基因编辑
此外,在最近的一篇Nature
Biotechnology文章中,张锋研究组为了解决常用Cpf1:AsCpf1和LbCpf1受限于PAM序列的问题,设计了携带S542R/K607R和S542R/K548V/N552R突变的两个AsCpf1变体,这两个突变分别识别TYCV和TATV
PAM。结果证明这两种新的AsCpf1不仅保留了DNA靶向高特异性,而且也通过引入一种非PAM相互作用突变得到了进一步改善。















