▎药明
康德/报道
Alnylam Pharmaceuticals和赛诺菲(Sanofi)旗下健赞(Genzyme)公司今天公布了
一条重磅新闻
——其RNAi在研新药patisiran在
治疗多发神经病变性遗传性ATTR型淀粉样变的3期临床试验中,取得了极佳的成果,
达到了主要终点和所有次要终点!
这也意味着在
近20年前被发现,并于
2006年获得诺贝尔生理学或医学奖的RNAi技术终于在人类临床中得到正名,首款RNAi疗法也有望在近期获批上市!

遗传性运甲状腺素蛋白(TTR)介导(hATTR)淀粉样变是一种
遗传的、使人逐渐衰弱的、由
TTR
基因突变引起的致命疾病。
TTR蛋白主要在肝脏中产生,通常是维生素A的载体,TTR突变导致异常的淀粉样蛋白积累,并损伤身体器官和组织,如外围神经和心脏,导致难以治疗的外周感官神经病变、自主神经病变和心肌病。hATTR淀粉样病是一个重大未满足的医疗需求,发病率和死亡率很高,全世界影响着约5万人。
hATTR淀粉样病患者从症状发作开始时,平均寿命为2.5 - 15年
,而唯一获得批准的治疗方案是疾病早期时的肝移植和tafamidis(在欧洲、日本和拉丁美洲的某些国家获得批准)。对于治疗hATTR淀粉样变的新疗法尚还有很大需求。
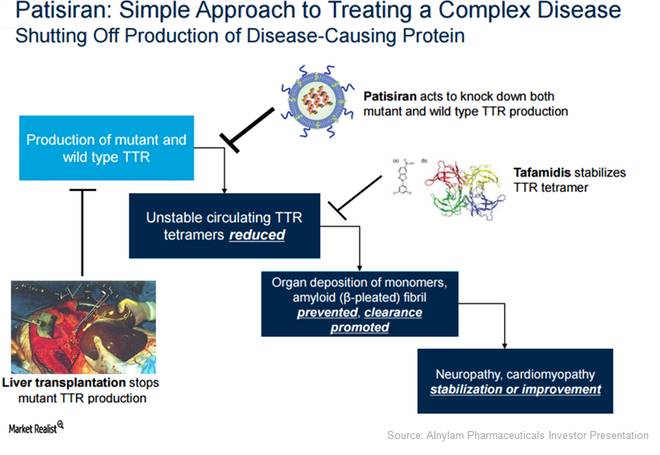
▲Patisiran的作用机理(
图片来源:
Alnylam官方网站
)
Patisiran利用身体的天然机制,降低引起TTR淀粉样变的TTR蛋白的水平。
它可以靶向和沉默特定信使RNA,阻碍TTR蛋白生成。
可有助于清除周围组织的TTR淀粉样蛋白沉积,并恢复这些组织的功能。

▲药明康德相关阅读:
诺贝尔奖一定能带来新药吗?
(
图片来源:诺贝尔奖官方网站)
APOLLO 3期临床研究是一项随机、双盲、安慰剂对照的全球性研究,旨在评估patisiran在hATTR淀粉样变症患者中的有效性和安全性。这项试验在全球19个国家的44个研究地点,招募了225名hATTR多发性神经病变淀粉样变患者,涵盖了39个基因型。患者按2:1的比例随机分配到patisiran治疗组和安慰剂对照组, 在18个月的期间内,每三周静脉注射0.3 mg/kg patisiran。
这项研究的主要终点是在18个月期间内,修正神经病变损害评分(mNIS + 7)从基线的变化。
mNIS + 7是一个神经损伤的综合测量,评估感觉运动能力、神经传导、反射和自主功能。
次要终点包括Norfolk QOL-DN生活质量评分以及机械力量(NIS-W)、残疾(R-ODS)、步速(10米步行测试)、营养状况(mBMI)和自主症状(COMPASS-31)。
探索性终点包括有心脏介入患者的心脏测量,以及测量皮肤淀粉样负荷和神经纤维密度的皮肤活组织检查。对于mNIS + 7和Norfolk QOL-DN测量,较低分数意味着更好的临床结果。




