BioArt按
:
结肠腺瘤息肉易感蛋白(Adenomatous Polyposis Coli,
APC)
是与结肠癌发生发展密切相关的蛋白。临床研究发现APC在80%以上的结肠癌恶性转移患者中异常结合Asef蛋白并持续激活其鸟苷酸活化因子活性,从而在结肠癌的恶性转移中发挥重要作用。那么
APC-Asef蛋白相互作用是否可以作为阻断结肠癌恶性转移的靶标设计抑制剂呢?
7月24日,来自上海交大医学院
张健
课题组和
余健秀
课题组合作在
Nature Chemical Biology
上发表了题为“peptidomimetic inhibitors of apC–asef interaction block colorectal cancer migration”的研究论文,
该
研究合理设计了结肠癌转移靶标APC-Asef蛋白相互作用的首个抑制剂MAIT-203,揭示APC-Asef相互作用介导结肠癌转移的潜在通路机制,为结肠癌转移的潜在治疗开辟了新的方向。

论文解读:
结肠癌是世界第三大常见癌症,死亡率高达60%,结肠癌恶性转移是结肠癌患者高死亡率的主要原因之一。
结肠腺瘤息肉易感蛋白
(Adenomatous Polyposis Coli,
APC
)是与结肠癌发生发展密切相关的蛋白。临床研究发现APC在80%以上的结肠癌恶性转移患者中异常结合Asef蛋白(又被称为Rho guanine nucleotide exchange factor 4)并持续激活其鸟苷酸活化因子活性,从而在结肠癌的恶性转移中发挥重要作用【1】。
为了探索APC-Asef蛋白相互作用是否可以作为阻断结肠癌恶性转移的靶标设计抑制剂,研究人员进行了APC-Asef蛋白相互作用机制研究,发现Asef通过其ABR结构域的25个残基结合在APC的ARM结构域表面超过2500Å
2
宽大浅平口袋中。
为了克服蛋白相互作用口袋大且表浅,不易设计抑制剂的天然缺陷,在张健研究员的带领下,研究人员发展了诱导契合的蛋白相互作用界面小分子设计方法,利用合理诱导APC口袋中残基构象将APC原本难以结合小分子的宽大平坦口袋转变为环形类药性口袋,并采用结构为基础的药物设计方法优化获得结合APC口袋的首个抑制剂
MAIT-203(
下图
)
。
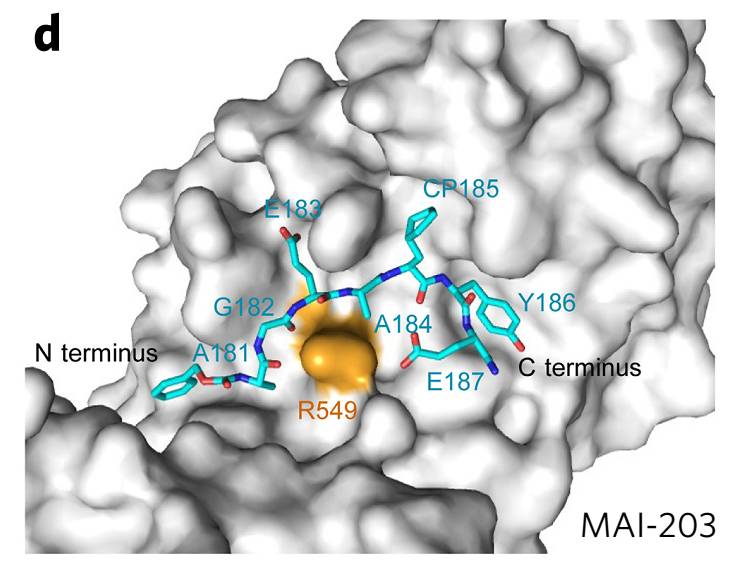
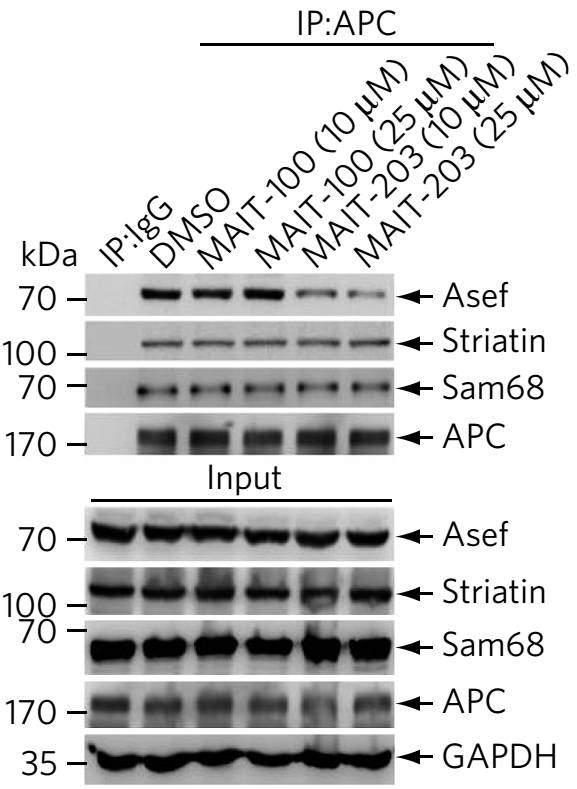
该系列抑制剂可以选择性阻断APC-Asef蛋白相互作用,最高抑制活性Ki值高达15nM,强于APC-Asef蛋白相互作用亲和力,且不影响APC和其他蛋白的亲和力(
下图
)。进一步,他们证实该抑制剂可以通过破坏APC-Asef蛋白相互作用阻断结肠癌的恶性转移。
利用该抑制剂,他们在研究中还识别了结肠癌中APC-Asef蛋白相互作用激活的直接下游GTPase为CDC42,并进而发现结肠癌中多个APC-Asef蛋白相互作用激活的信号通路
。
据了解,该课题组下一步的研究将深入探索结肠癌中APC-Asef蛋白相互作用调控的转移通路机制,优化先导化合物MAIT-203的成药性,开发低毒高效的新型抗结肠癌恶性转移药物。
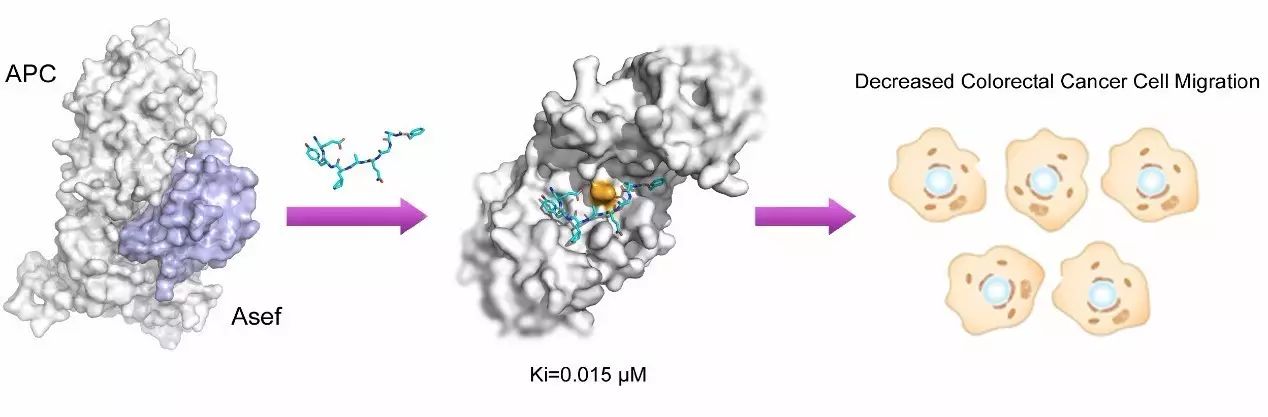
图1. 研究工作流程
药物设计方法的发展为重大疾病全新靶点识别和First-in-class药物发现提供了高效突破工具
。据悉,张健课题组自2009年起长期致力于与全新靶标相关的精准药物设计工作,特别是在药物设计方法发展,精准靶标识别和First-in-class药物发现领域取得系列成绩,以通讯作者在
Nat Chem Biol, Chem Rev, Chem Soc Rev, Am J Hum Genet, Nucleic Acids Res, Bioinformatics, Structure, ACS Med Chem Lett
等多个重要学术期刊上发表了一系列药物设计成果。本研究由
张健
研究员联合
余健秀
研究员共同完成,张健及余健秀为共同通讯作者,
姜海明
博士、
邓蓉
博士以及
杨秀岩
博士为共同第一作者。此外,上海交通大学
陈国强
教授,
吴更
教授,华东理工大学
李剑
教授,中国科学院上海健康研究所
秦樾
研究员,中国科学院上海硅酸盐所
陈雨
研究员对论文亦有贡献。
参考文献:
1、Kawasaki, Y., Sato, R. & Akiyama, T. Mutated APC and Asef are involved in the migration of colorectal tumour cells.
Nat. Cell Biol
. 5, 211–215 (2003).

张健
,博士,上海交通大学医学院研究员,课题组长,医药生物信息学中心主任,中组部万人计划青年拔尖人才及国家自然科学基金优秀青年基金获得者,兼任上海市特聘教授东方学者。2002年毕业于北京大学医学部药学院,获理学学位,北京大学优秀毕业生,免试推荐至中国科学院上海药物研究所, 2007年获得药学博士学位,全国优秀博士论文。2009年7月起至今受聘上海交通大学医学院任研究员、博士生导师、课题组长。张健研究员主要从事的研究涉及药物设计、药物化学、化学生物学和生物信息学领域,特别是变构药物设计方法发展、精准靶标识别和First-in-class药物发现等方向做出了一系列突破性成果。近五年来以通讯作者在包括
Nat Chem Biol, Chem Rev, Chem Soc Rev, Am J Hum Gen, Nucleic Acids Res
等国际学术杂志上发表SCI论文60余篇,他引超过3500次,H因子为31,获国内外专利9项(第一发明人5项)。受Springer-Nature出版社邀请作为主编编写“Allosteric drug design”一书,并获邀请将其发展的变构方法和标准写入Elseiver出版社经典药物化学丛书“Comprehensive Medicinal Chemistry III”(2017)及Springer出版社的“Methods in Molecular Biology”(2017)丛书。担任中国化学会专业委员会委员,国际药学杂志
Acta Pharmaceutica Sinica
等编委及
Nat Commun
等四十余种SCI期刊审稿人,先后主持国家自然科学基金、教育部全国优博专项基金、国家重大新药创制等项目。曾获
Roche Creative Chemistry Award
、上海市卫生系统人才最高奖银蛇奖和上海市药学科技三等奖等。

余健秀,博士,现任上海交通大学医学院研究员,博导。
长期从事肿瘤抑制蛋白质修饰与信号传导、非编码RNA调节肿瘤发生发展及转移等的研究。发现转录因子EGR1 是一个重要的肿瘤抑制蛋白,阐述了EGR1 磷酸化或乙酰化,能上调或下调P300 及CBP 基因的转录,从而控制细胞增殖或凋亡(Yu et al.
Molecular Cell
, 2004);发现磷酸化--SUMO 化的EGR1 可以有选择地激活与细胞凋亡有关的PTEN、p53和 p73 转录而发挥其肿瘤抑制功能(Yu et al.
Cell Death and Differentiation
, 2007; Yu et al.
EMBO J
, 2009)。2009年9月回国,任上海交通大学医学院研究员。近期研究组取得一些重大进展,发现SUMO化修饰直接介导PTEN膜结合调节PI3K-AKT信号通路并在肿瘤发生发展中起决定性作用,相关论文发表在
Nature Communications
(2012)。在
Nature Communications, Molecular Cell, EMBO J, PNAS, Cell Death Differentiation, JBC
等国际著名刊物上发表研究论文30余篇(他引500余次)。获国家发明专利2项,其中1项已转让于大型生物工程公司。近期获国家973计划子课题、国家自然科学基金重大研究培育计划及面上项目、上海浦江人才发展基金等资助。现担任
American Medical Journal
编委,以及
Cellular and Molecular Life Sciences, Oncogene, JBC
等审稿人。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





