溶出度系指药物从片剂、胶囊剂和颗粒剂等固体制剂在规定的条件下溶出的速率和程度。它是一种模拟口服固体制剂在胃肠道中的崩解和溶出的体外试验法,是评价和控制药品制剂质量的一个重要指标,不但对控制制剂的质量的一致性、筛选处方和优化工艺具有重要作用,而且对体内药代动力学特征也具有一定的指导意义。

尽管“溶出曲线相似”,“高区分力的溶出曲线”已经是老生长谈,但真正理并能灵活运用的人并不多。对于同一个产品,不同理解程度的人开发的溶出方法也不同,所以出自不同人之手的
“
溶出相似
”
也不同,也许这就是同样是四条溶出曲线相似,
BE
有的一致,有的不一致的一大原因。在此,本人就班门弄斧一下,简单地谈一下我实际工作中溶出方法学开发的思路。
在开发溶出方法之前,原料药的性质必须要搞明白,比如
药物的Pka值,
API在不同pH条件下的溶解度差异,不同晶型的溶解度差异,介质的离子强度对药物的溶解度的影响,API在不同PH溶液状态下的稳定性。了解这些性质对后续溶出介质筛选可提供指导性意义,尤其是需要加表面活性剂的溶出介质。需要注意的是,绝大部分产品在尚未达到漏槽条件的介质中就可以很好地溶出来了,无需过量添加表面活性剂达到漏槽条件,如一味苛求漏槽条件,溶出曲线的分辨率会大打折扣。与此同时,还要重视药物在不同pH值的缓冲液中的稳定性,如样品不稳定,筛选介质时应避开或施加其它的样品处理方法解决或降低药物的分解,以保障溶出量检测的准确性。开发溶出方法前,弄清楚缓冲液的离子浓度对原料药溶解度的影响也是有必要的,因为很多离子型原料的溶出容易受介质离子强度的干扰,而不同国家药典收载的缓冲液配制方法往往有所不同,不但如此,我国药典和溶出指导原则里推荐的都有差异。
溶出度方法的选择
2015
年中国药典附录中收载的溶出方法有五种,最常用的是篮法
(
一法
)
和桨法
(
二法
)
。胶囊首选篮法,片剂首选桨法,对于有药典或FDA/PMDA溶出数据库有推荐使用篮法或桨法的产品,可以直接使用相应的方法进行溶出方法学的开发,当然,如篮法溶出的过程中有碎屑堵篮网而影响溶出的现象,可以考虑改为桨法;对于漂浮的,中途更换介质的,建议考虑篮法;对于气泡影响溶出的产品,建议使用桨法。在桨法检查过程中,如有片剂或胶囊漂浮于液面或贴壁的现象,可使用沉降篮
(Sinker)
,以帮助制剂定位于中心位置,降低溶出差异。
溶出介质的选择
对于难溶药物,
通常情况下,为得到可靠的溶出度数据,可以考虑加人表面活性剂,但一般不鼓励使用水一有机溶剂的溶出体系,除非有理由可证明单用水性介质无法得到体内外相关性,而水一有机溶剂的溶出体系可以获得体内外相关性。
根据溶出知道原则,一般需要筛选4个介质,水介质是必不可少的,然而水介质的变异性最大,因为:(1)不同来源的水质量不同,其pH是在一定范围变化的;(2)选择水为溶出介质时,原料药和辅料可能引起其pH发生变化:(3)水表面张力可能随处方中辅料发生变化。但是由于水廉价、易得,对于药物溶出速率与pH无关的制剂,水是适合的介质。同时,如果国家药品标准或药典标准中已选择水为检查介质,一般不必再改用其他介质,除非有确切的原因。
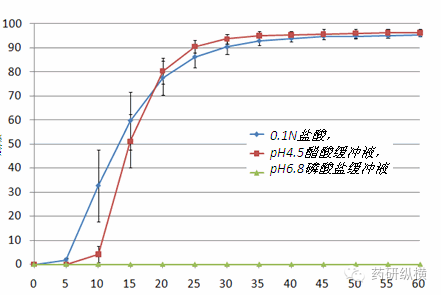
对于普通口服制剂的溶出行为考察需在pH1.2~6.8范围内进行评级。在方法的建立阶段,有必要对溶出前后的pH是否发生变化进行检查。指导原则推荐的四种介质分别为:盐酸溶液(常用浓度0.01~0.1 mol/L )、醋酸盐缓冲液(pH 3.0~5.5)、磷酸盐缓冲液(0.05mol/L,pH 4.0~6.8)和纯水。其中三种pH值的缓冲液,优选0.1N盐酸,pH4.5和pH6.8,如这三个pH值不适用,可以在相应的范围内调整,比如药物的PKa为5.8,我们可以选择PH5.0缓冲液,而不是PH4.5。介质体积优选500ml,900ml和1000ml,对于需要加表面活性剂的,还需要筛选表面活性剂的浓度。最常用的表面活性剂为吐温和十二烷基硫酸钠(SDS),一般以0.01%为起始剂量,慢慢往上递增,增加表面活性剂的浓度往往与转述相关联,0.01%SDS在75rpm的条件下可以溶出80%以上的情况,就没有必要将SDS增加至0.02%。
对于在胃部快速溶解的高渗透型品种,胃排空时间往往是吸收的限速因素,对于这类药物,溶出度检查主要是证明药物在胃液条件下可以快速溶出。而对于药物主要在肠道溶出的,如难溶性药物、弱酸,选择较高的pH范围(如pH 6.8的人工肠液)可能是适宜的介质。尽管体内环境中,食物、蛋白和脂肪等高分子在一定程度上可增加溶出(相当于0.3-0.5%的磷脂水平?),一般情况下不建议将表面活性加到1%以上水平。





