专栏名称: E药研发
| 天道酬勤 厚德载物 您好欢迎关注医药研发我们有非常专业的团队和老师,主要从事医药 化工 食品 实验室 仪器设备等方向的专业培训和指导 关注我们 您可能获得免费资料 可能获取更多的知识收益 |
目录
相关文章推荐

|
江西药品监管 · 防治流感,官方点名了这6种药! · 昨天 |

|
药渡 · 好书推荐 | ... · 2 天前 |

|
医药经济报 · 呼吸疾病TSLP靶点差异竞跑 · 3 天前 |

|
医药经济报 · 生物类似药市场浪花翻涌 · 4 天前 |

|
药明康德 · 肿瘤缓解患者比例翻4倍,还延长生存期!《柳叶 ... · 5 天前 |
推荐文章

|
江西药品监管 · 防治流感,官方点名了这6种药! 昨天 |

|
药渡 · 好书推荐 | 类药性:概念、结构设计与方法(原著第二版) 2 天前 |

|
医药经济报 · 呼吸疾病TSLP靶点差异竞跑 3 天前 |

|
医药经济报 · 生物类似药市场浪花翻涌 4 天前 |

|
药明康德 · 肿瘤缓解患者比例翻4倍,还延长生存期!《柳叶刀》子刊:新药联合标准治疗,效果更好 5 天前 |

|
古玩元素网 · 登封造极的彩瓷:清三代(雍正)珐琅彩瓷器(中) 8 年前 |

|
今日日本 · 怀孕期间用什么护肤品好?推荐这21款给你! 7 年前 |

|
时尚先生 · Esquiz 72 | 一个悲伤的消息,苹果可能不会出 iPhone 8 了 7 年前 |

|
互联网分析沙龙 · 这里有150本免费行业畅销书+1000多份简历模板等你领走! 7 年前 |
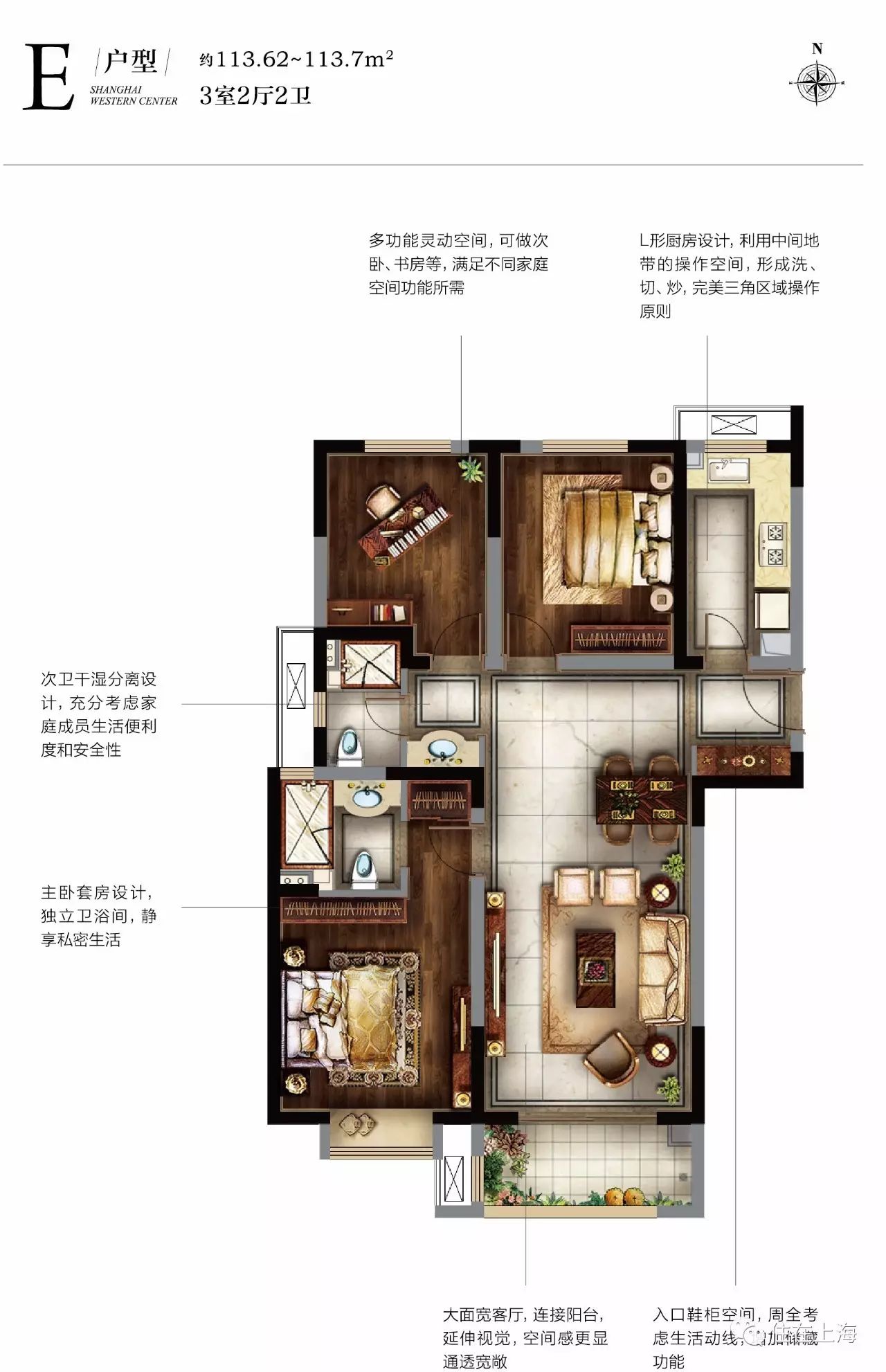
|
住在上海 · 4月一手房销冠项目 星信名邸|约113平南北通三房E户型 少量在售! 7 年前 |
