
Suparna B. Wedam, Julia A. Beaver, Laleh Amiri-Kordestani, Erik Bloomquist, Shenghui Tang, Kirsten B. Goldberg, Rajeshwari Sridhara, Amna Ibrahim, Geoffrey Kim, Paul Kluetz, Amy McKee, Richard Pazdur
翻译:苏州大学附属第一医院 屠俊浩
审校:江苏省人民医院 黄香
点评
美国 FDA 对转移性乳腺癌研究中单纯骨转移患者对临床试验结果的影响的及这类患者影像学评估的汇总分析
点评专家:
陈佳艺
上海交通大学医学院附属瑞金医院
转移性
乳腺癌的临床试验是否合适纳入骨转移患者,乃至是否允许纳入仅有骨转移患者,在不同的研究中定义不同,总体而言,受到几个因素影响:①骨是乳腺癌高发的转移器官,但是单纯骨转移在临床上的比例并不高,在不同的分子分型中有较大的差别;②骨转移在影像学上表现为以溶骨为主或以成骨为主,但两者往往混合,影像学评估始终是挑战;当研究对象仅有骨转移时,影像学评估的合理性和一致性,对研究者来说始终是个比较大的挑战;③当骨转移患者合并其他脏器转移时,往往采用其他脏器病灶作为可评估病灶,从已发表的临床研究中获得骨转移患者的疗效分析也存在困难。
鉴于上述长期存在的疑惑和关注,该研究分析了自
2005
年以来递交至美国
FDA
的所有研究对象为转移性乳腺癌研究对象的研究,对每个研究,根据研究起始时纳入的患者,划分为:
①仅有骨转移;②骨转移合并其他脏器转移;③基线无骨转移。一共
13
项研究纳入了本次分析,其中
9
个研究提供了研究者和盲法独立中央评估机构之间对骨转移病灶疗效评估的差异,包括早期差异率(研究者比中央评估更早定义进展)和晚期差异率(研究者比中央评估更晚定义进展)。
通过汇总分析,作者首先证实了在纳入研究的基线时,激素受体阳性、
HER2
阴性患者发生以骨转移为单一转移部位的比例(
15%
),高于
HER2
阳性(
5.9%
)和三阴性(
4.0%
)的患者。
绝经后患者的比例也高于绝经前(
13.7% vs. 8.3%
)。
从研究结果来看,无论研究药物是一线、二线或者三线治疗,单纯骨转移患者的无进展生存率和总生存率都高于其他两组,这个结果也提示读者比较不同研究结果时需要把单纯骨转移患者的纳入比例考虑在内。
虽然研究基线纳入单纯骨转移患者的比例随着研究入组对象的要求不同而有较大差异(
42%-73%
),但研究者和盲法独立中央评估对骨转移疗效评估的差异方向却非常一致:
单纯骨转移患者的早期差异率几乎都高于骨转移合并其他脏器转移或者基线无骨转移,也就是说,当骨转移作为疗效评估的唯一器官时,研究者往往都倾向于过早地判断病灶进展。转移性乳腺癌,尤其当研究对象是激素受体阳性、
HER2
阴性患者时,纳入单纯骨转移患者是合理而且需要的。
RECIST
作为疗效评估的主要体系,在骨转移的疗效评估方面始终有待于完善
[1]
,包括究竟是单一影像手段还是联合影像手段;
来自前列腺癌的经验教训同样适用于内分泌治疗患者带来早期一过性的病灶假性进
[
2
]
;核医学检查在严重溶骨患者早期疗效改善的时候也会出现假性进展的影像。在临床试验中越来越需要纳入骨转移患者,所以完善骨转移病灶的疗效评估体系显得尤为重要,这可能也是这篇汇总分析受到关注的原因。

摘要
目的
仅骨(
bone-only, BO
)转移性乳腺癌(
metastatic breast cancer, MBC
)患者的比例及预后尚未得到很好的阐述。
我们尝试分析临床研究中仅骨转移乳腺癌患者的不同预后,并探讨研究者与独立盲态审核中心评价在影像学诊断方面是否存在差异。
方法
我们汇总分析了自
2005
年以来作为初始或补充新药或生物制剂许可申请提交的
MBC
治疗的
13
项前瞻性研究中
10,521
例患者的数据。
分为三个亚组进行评估:
BO
组、骨转移伴其他转移组(
bone with other metastases, BWO
)和无骨转移组(
no bone metastases, NBM
)。
分别计算出盲性独立中心评价的
3,733
和
2,813
例患者的早期差异率和晚期差异率。
结果
骨转移患者占总入组患者的
49%
(范围为
42%-73%
)。
其中
BO
患者占
12.5%
(范围为
4%-26%
),取决于不同的分子亚型。
汇总试验中研究者评估的无进展生存期(
progression-free survival, PFS
)和总生存期(
overall survival, OS
)显示:
与其他两组相比,
BO
组有更好的预后(
BO v BWO PFS
风险比
[hazard ratio, HR]
,
0.64
;
95%
置信区间
[confidence interval, CI]
,
0.591-0.696
;
BO v NBM PFS HR
,
0.70
;
95% CI
,
0.65-0.76
;
BO v BWO OS HR
,
0.56
;
95% CI
,
0.50-0.61
;
BO v NBM OS HR
,
0.68
;
95% CI
,
0.61-0.76
)。
与
BWO
组和
NBM
组相比,
BO
组有更高的早期差异率和更低的晚期差异率。
结论
据我们所知,本综述是迄今为止对转移性乳腺癌
BO
组数据最大规模的分析,发现该组患者可能具有独特的自然病程。同时还发现,与另外两组相比,研究者对
BO
组疾病进展的评估似乎也存在差异。
J Clin Oncol 36:1225-1231. © 2018 by American Society of Clinical Oncology
前言
骨转移在转移性乳腺癌(
metastatic breast cancer, MBC
)
[1
]
中很普遍,是其发病的主要诱因之一
[
2,3
]
。
然而,
仅骨转移(
bone-only, BO
)的
MBC
并不常见
[4]
,因此在临床研究中通常与非
BO
疾病合并,很少单独作为一个分层变量。
既往研究发现与非
BO
疾病相比,
BO MBC
有着不同的自然病程和更好的预后,特别是在激素受体(
hormone receptor, HR
)阳性的
MBC
[
5-7
]
中更明显。
然而,这些研究的样本量极为有限。我们试图采用一种更全面
的方法来研究
BO MBC
。
由于溶骨性和成骨性病灶都可能存在
[8]
,使得乳腺癌骨转移的影像学诊断变得困难且更具挑战。当仅有骨转移病灶,而没有其他病灶进行可靠的随访时,这一点尤其成问题,可导致这些没有可测量病灶的患者无法纳入临床研究。
MBC
的骨转移检测存在多种影像学方法,但大多数乳腺癌指南和共识并没有推荐优先使用何种检测方法。因此,临床研究和临床实践中所使用的成像方式存在很大差异。评估
BO MBC
患者对治疗的反应也是一个独特的挑战,因为在某些成像方式(计算机断层扫描、骨扫描)中发现的硬化增加或者骨扫描中的代谢异常,实际与治疗反应相关,却可能会被误认为是进展。此外,目前没有可靠的评价标准用来评估骨转移的疗效。实体瘤疗效评价标准(
Response Evaluation Criteria in Solid Tumors, RECIST
)
[9]
作为临床研究中使用最广泛的标准也不足以评估骨转移的疗效。
美国食品药品监督管理局(
US Food and Drug Administration, FDA
)对于新药或补充药物的上市申请,会全面检测其有效性和安全性。疗效终点例如总缓解率和无进展生存期(
progression-free survival, PFS
)需要借助肿瘤影像学评估。因此,
FDA
在根据疗效终点做出监管决策之前,必须确定好有效的影像学手段和评价标准。评估骨转移疗效的困难可能导致研究者与独立盲态审核中心评价(
blinded independent central review, BICR
)存在差异,并可能影响药物疗效的表征。据我们所知,在
BO
疾病中研究者评估与
BCIR
评估的差异在此前的多项研究中尚未进行全面研究。因此,为了进一步研究
BO
组,我们对自
2005
年以来提交至
FDA
的关于
MBC
的研究进行分析。
方法
纳入标准
我们在
FDA
电子数据库中搜索了自
2005
年(当电子数据集首次提交审查时)以来作为初始或补充新药或生物制剂许可申请提交的关于
MBC
的研究。
纳入的研究仅限于提交电子数据集的随机、阳性对照研究。
对每项研究的基线病灶数据(包括靶病变和非靶病变)进行系统分析。根据入组临床研究时的疾病部位将每例乳腺癌患者分入三组之一:基线仅骨转移组(
BO
)、基线骨转移伴其他转移组(
bone plus other lesions at baseline, BWO
)、基线无骨转移组(
no bone metastases at baseline, NBM
)。
评估预后的指标包括:研究者评估的
PFS
、
BICR
(如果可行)评估的
PFS
和总生存期(
overall survival, OS
)数据。
如果可行,更新
PFS
或
OS
数据进行分析。
我们还收集了各亚组的其他数据,包括绝经后状态、
HR
状态(雌激素和
/
或孕酮受体)、人表皮生长因子受体
2
(
HER2
)状态、年龄、转移治疗线数(一线或一线以上)、以及患者是否被随机分配到治疗组或对照组。
统计方法
每项研究中三组(
BO
、
BWO
和
NBM
)的比例是结合乳腺癌亚型(如
HR
阳性、
HER2
阳性、三阴性)和其他亚型来描述的。
另外,所有研究结果均通过基于脆弱性的
Cox
比例风险生存模型
[10]
进行评估。
通过这种方法,全分析集中的每个研究都可以随 γ 脆弱模型而变化,同时仍可以评估诸如风险比(
hazard ratio, HR
)等相关指标。
这种方法允许
BO
组与另外两组进行跨研究比较。
为了处理每一研究中的固有差异,引入了一个脆弱参数,以允许跨研究中产生随机效应。
回归分析仅能够校正特定研究中患者是否被随机分配至治疗组。
虽然对其他协变量也进行了检测,但并不能成为最终结果的一部分。这主要是因为除了年龄之外的大部分协变量(如绝经状态、雌激素受体状态、
HER2
状态)都是纳入
/
排除标准,因此,因研究之间差异而使用的脆弱参数混淆了这些协变量。
我们分析了研究者评估的
PFS
与
BICR
评估的
PFS
之间的不一致性。
共有
6,305
例患者(来自
9
项研究)参与了
BICR
审查。
通过之前介绍的方
[11]
,来评估早期差异率(
early discordance rate, EDR
)和晚期差异率(
late discordance rate, LDR
)。
EDR
表示研究者评估进展早于
BICR
评估进展的事件占研究者评估进展总事件的比例。
这里的早期分为两种:一、研究者评估为进展而
BICR
评估为非进展;
二、研究者和
BICR
皆评估为进展,但研究者评估在时间上早于
BICR
。
同理,
LDR
表示研究者评估与
BICR
评估不一致时,前者评估进展晚于后者评估进展的比例(一致意味着两者同时评估是否为进展)。
至于
EDR
和
LDR
的数学定义,可以参考
Amit 等
[11]
对两者的定义。
总差异率定义为研究者评估和
BICR
评估不一致患者数占参与
BICR
审查总患者数的比例。
总差异率和
LDR
之间分母不同。
在评估
EDR
和
LDR
时, 我 们 提 出 了 有 效 样 本 量(
effffective sample size, ESS
)概念,作为在计算
EDR
和
LDR
时使用的分母。
统计分析由
SAS
(版本
9.3
;
SAS Institute, Cary, NC
)进行。
图由
R
软件包制作完成。
结果
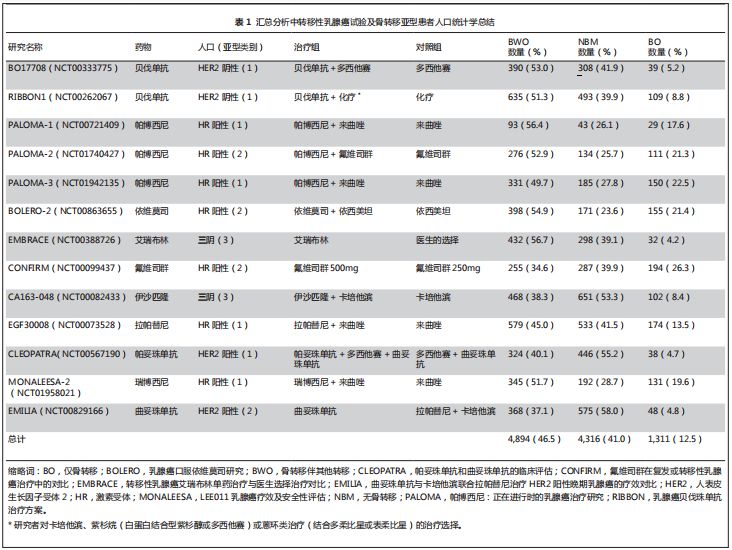
表
1
所示,对
10
种用于治疗转移性乳腺癌的试验性药物的
13
项临床研究(
n=10,521
)进行汇总分析。
这
10
种试验性药物包括:
2
种化疗药物、
1
种生物制剂联合化疗药物、
4
种用于
HR
阳性乳腺癌的治疗药物、
3
种
HER2
靶向药物。
如表
1
所示:
尽管纳入
BO
组的标准不统一,但
13
项临床研究中都有
BO
疾病患者。
13
项研究中有
7
项研究的患者纳入时须有可衡量病灶,其中
4
项研究在骨病灶满足特定要求时(即,主要是溶骨性转移或经影像学确认),则特许
BO
疾病入组。
其他三项需要可衡量病灶的试验未提及
BO
疾病是否合格。
13
项研究的另外
6
项研究则允许患者有可测量和
/
或不可测量病灶。
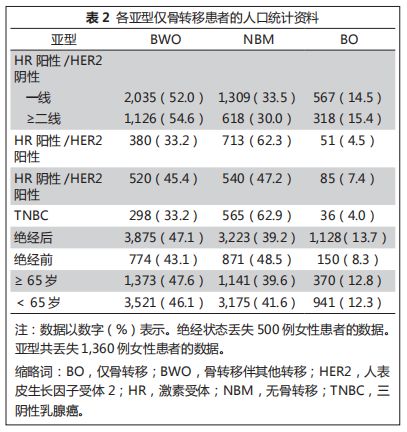 表
2
所示,研究中骨转移疾病占
49%
(范围为
42%-73%
),
BO
疾病的比例为
12.5%
(范围为
4%-26%
),根据分子亚型和绝经状态不同而变化。
HER2
阳性疾病和三阴性疾病患者具有低水平
BO
疾病(
HER2
阳性,
5.9%
;
三阴性乳腺癌,
4.0%
),而
HR
阳性疾病中
BO
疾病约占
15%
。
表
2
所示,研究中骨转移疾病占
49%
(范围为
42%-73%
),
BO
疾病的比例为
12.5%
(范围为
4%-26%
),根据分子亚型和绝经状态不同而变化。
HER2
阳性疾病和三阴性疾病患者具有低水平
BO
疾病(
HER2
阳性,
5.9%
;
三阴性乳腺癌,
4.0%
),而
HR
阳性疾病中
BO
疾病约占
15%
。
时间 - 事件分析
PFS
在所有
12
项研究中的定义是相同的:
PFS
定义为从随机分组直到首次记录的肿瘤进展或死亡的时间,以先发生者为准。
汇总研究的
PFS
(由研究者评估)数据显示:
与
BWO
亚组相比,
BO
亚组
HR
为
0.64
(
95% CI
,
0.591-0.696
);
与
NBM
亚组相比,
BO
亚组
HR
为
0.70
(
95% CI
,
0.65-0.76
);
与
NBM
和
BWO
合并亚组相比,
BO
亚 组
HR
为
0.67
(
95% CI
,
0.62-0.73
)。
与
BWO
亚组相比,
NBM
亚组
HR
为
0.90
(
95% CI
,
0.86-0.95
)。
Cox
比例风险模型显示
BO
疾病状态和治疗组之间没有发现相互作用。
跨研究汇总的
OS
数据也显示出类似的趋势:
与
BWO
亚组相比,
BO
亚组
HR
为
0.56
(
95% CI
,
0.50-0.61
);
与
NBM
亚组相比,
BO
亚组
HR
为
0.68
(
95% CI
,
0.61-0.76
);
与
WBO
和
NBM
合并亚组相比,
BO
亚组
HR
为
0.61
(
95% CI
,
0.55-0.67
)。
与
BWO
亚组相比,
NBM
亚组
HR
为
0.80
(
95% CI
,
0.76-0.86
)。
和
PFS
相似,
BO
疾病状态与治疗组之间没有相互作用。
除了以上跨研究汇总数据外,我们还分析了三种不同治疗方法的结果:
HR
阳性、
HER2
阴性患者接受一线治疗组(所有治疗);
HR
阳性、
HER2
阴性患者接受二线治疗组(所有治疗);
以及接受三线化疗组。在每种治疗方法中,将患者纳入在治疗组中,并通过
BO
、
BWO
、
NBM
状态呈现数据。
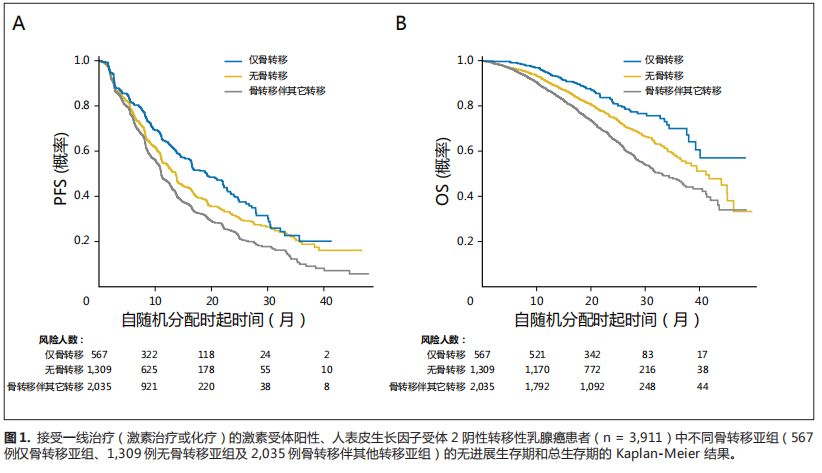
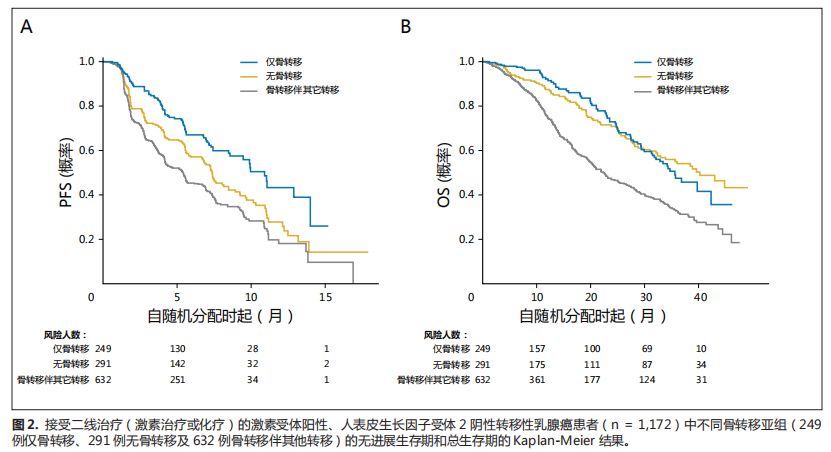
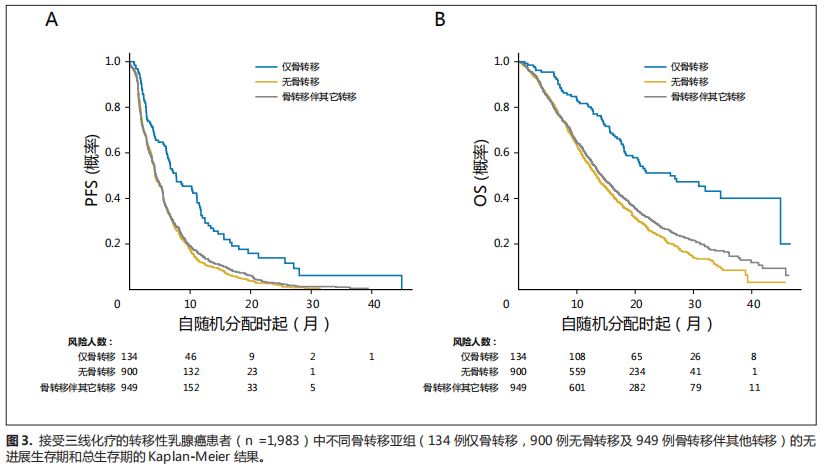
图
1-3
显示了
PFS
和
OS
数据的
Kaplan-Meier
结果。
 如图
1-3
所示,
PFS
在所有疾病分组中呈现一致的趋势。
BO
组中
PFS
效果良好,其次分别是
NBM
亚组和
BWO
亚组。
对于
OS
而言,接受一线治疗和三线治疗的患者中,
BO
组生存优于另外两组(图
1
和
3
)。
然而,接受二线化疗的患者中,当与
NBM
亚组相比时,
BO
亚组具有混合结果(图
2
)。
但是,与
BWO
亚组相比,
BO
亚组有更好的治疗效果。
如图
1-3
所示,
PFS
在所有疾病分组中呈现一致的趋势。
BO
组中
PFS
效果良好,其次分别是
NBM
亚组和
BWO
亚组。
对于
OS
而言,接受一线治疗和三线治疗的患者中,
BO
组生存优于另外两组(图
1
和
3
)。
然而,接受二线化疗的患者中,当与
NBM
亚组相比时,
BO
亚组具有混合结果(图
2
)。
但是,与
BWO
亚组相比,
BO
亚组有更好的治疗效果。
 地方和中央审查之间的差异
PFS
的
EDR
和
LDR
率由经研究者和
BICR
评估
PFS
的患者估算。
表
1
所示的
10,521
例患者中,包括来自
9
项研究的
6,305
例患者。
6,305
例患者中,
BWO
组
2,987
例、
NBM
组
2,509
例、
BO
组
809
例。
计算
EDR
的有效样本量为
3,733
例(占总患者的
35.5%
),计算
LDR
的有效样本量为
2,813
例(占总患者的
26.7%
)。
BO
组中
373
例可用于计算
EDR
率,
323
例可用于计算
LDR
率。
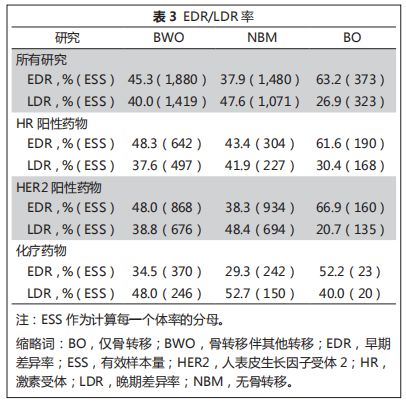
表
3
所示为不同乳腺癌亚型及靶向药物亚组中的
EDR
和
LDR
率。
各试验组的
EDR
和
LDR
率见表
4
。
该表显示,在所有研究中,
BO
亚组的
EDR
率高于
BWO
亚组和
NBM
亚组。
同时,
9
项研究中的
8
项均显示
BO
亚组的
LDR
率低于另外两组。
地方和中央审查之间的差异
PFS
的
EDR
和
LDR
率由经研究者和
BICR
评估
PFS
的患者估算。
表
1
所示的
10,521
例患者中,包括来自
9
项研究的
6,305
例患者。
6,305
例患者中,
BWO
组
2,987
例、
NBM
组
2,509
例、
BO
组
809
例。
计算
EDR
的有效样本量为
3,733
例(占总患者的
35.5%
),计算
LDR
的有效样本量为
2,813
例(占总患者的
26.7%
)。
BO
组中
373
例可用于计算
EDR
率,
323
例可用于计算
LDR
率。
表
3
所示为不同乳腺癌亚型及靶向药物亚组中的
EDR
和
LDR
率。
各试验组的
EDR
和
LDR
率见表
4
。
该表显示,在所有研究中,
BO
亚组的
EDR
率高于
BWO
亚组和
NBM
亚组。
同时,
9
项研究中的
8
项均显示
BO
亚组的
LDR
率低于另外两组。
我们通过
Fisher's
检验来检测
BO
亚组与
BWO















