
近年来,ADC赛道持续火热,呈现出资本竞逐的局面。3月初,宜联生物宣布,已在两个月内相继完成3.5亿元人民币的A轮融资,融资募集的资金将用于公司ADC产品管线的开发以及新型偶联药物研发平台的建设。
3月19日,齐鲁3500万美元引进的EpCAM ADC药物Vicineum已默认获批临床,拟用于非肌层浸润性膀胱癌。Vicineum的BLA于2月获得FDA的受理,并纳入优先审查,3月初向EMA递交了上市申请,有望今年年底获批上市。
目前,全球已有十款ADC药物获批上市,其中,T-DM1和Adcetris已于我国上市。
ADC药物主要由抗体、连接子(Linker)和细胞毒药物(Payload)三部分组成,但一款成功ADC药物的研发绝非简单的加法,而是各组分调整优化的有机结果。
正如可裂解linker可产生旁观者效应(Bystander effect),但也绝不可忽视其在血液循环中可能产生的更高脱靶毒性。
未来,随着技术的不断成熟和设计的日臻完善,ADC药物的质量和数量有望大幅提升,发展前景十分广阔。
部分早期ADC药物的抗体选择鼠源单抗和人鼠嵌合单抗,如Lumoxiti和Adcetris,但非人源化单抗易被人体免疫系统识别,引起人抗鼠抗体反应,导致抗体药物被免疫系统当作异源蛋白快速清除。
目前在研的ADC药物普遍以人源化单抗为主,克服了人抗鼠抗体反应,有效提升了抗体的亲和力。
抗体的亲和
力是指抗体与抗体结合力的强弱,通常用EC50和IC50表示。
EC50是指半数效应浓度,IC50为半数抑制浓度,EC50和IC50的值越小,抗体的亲和力越强,与靶点的结合能力越高。
随着抗体亲和力的提升,临床达标的最佳剂量越低,产生的副作用可能越小。
曲妥珠单抗是在HER2 ADC药物中常用的Antibody,T-DM1、DS-8201等均使用曲妥珠单抗。荣昌生物的RC48使用Disitamab的新型抗体,EC50仅为6.4pM,远低于曲妥珠单抗20.1pM,亲和力更强。不但副作用更低,而且对于HER2低表达的晚期实体瘤也有较好的临床疗效。

第一代ADC药物Mylotarg采用IgG4作为抗体,但IgG4分子无法引起Fc介导的ADCC、CDC和ADCP作用,因此在第二代和第三代ADC药物的设计中普遍采取可引起Fc介导免疫功能的IgG1。
但是,一个悬而未决的问题在于,ADC药物是否依赖ADCC和CDC作用,这点尚待进一步研究。一些研究认为ADC的单抗应尽快被靶细胞内吞,通过微管蛋白抑制剂和DNA抑制剂发挥杀伤作用,而单抗的ADCC和CDC作用仅是锦上添花。
可裂解Linker与不可裂解linker相比,优势在于可发挥旁观者效应(Bystander Effect)。Bystander Effect是指ADC药物裂解后,细胞毒药物可穿透细胞膜进入邻近的癌细胞发挥旁杀伤作用。在ADC药物的研发中,越来越多的ADC药物使用可裂解Linker,取代不可裂解Linker。
但是,可裂解Linker绝非完美。可裂解Linker存在靶外裂解风险,脱靶毒性通常较不可裂解Linker更高。此外,Bystander effect可能存在“误杀”风险,即当相邻细胞为正常细胞时,细胞毒药物则会穿透细胞膜“误杀”正常细胞。对此,DolaLock Payload应运而生,DolaLock payload为一种微管蛋白抑制剂,DolaLock payload在靶细胞中裂解后,可穿膜发挥旁观者效应。但很快DolaLock Payload便会代谢为一种依旧高效、但无法跨膜的形式,“锁”死在靶细胞中,进而有效控制旁观者效应。Mersana公司并未披露具体的技术细节,但可能与代谢的负电荷产物相关。
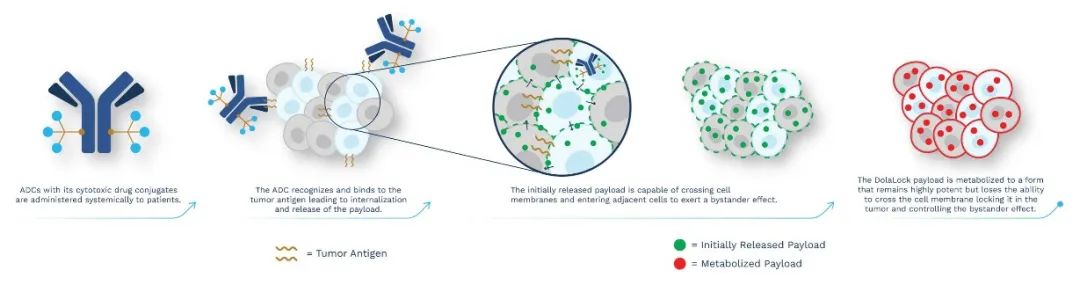
DolaLock Linker
02 随机偶联(赖氨酸——半胱氨酸)向定点偶联转变
常见的随机偶联包括赖氨酸随机偶联与半胱氨酸随机偶联。
早期
ADC药物常采用赖氨酸随机偶联,但新一代ADC药物更常使用半胱氨酸偶联。
这一转变的原因在于半胱氨酸的偶联方式较赖氨酸异质性更小,附着部位更容易预测。
单个抗体上存在8
0-100
个赖氨酸的氨基令偶联反应呈现高度随机性,造成
ADC药物的高度不均一性。
定点偶联是近年来新出现的连接方式,有望提升ADC产品的均一性,降低系统毒性。
常见的定点偶联方式包括Thiomab、ThioBridge、非天然氨基酸技术、GlycoConnect等
。
但断言定点偶联取代随机偶联,或为时过早。
一方面,所有的上市ADC品种均采用随机偶联,而Seattle Genetics的定点偶联产品已全部宣告失败;
另一方面,定点偶联产品的DAR值较低(2-4),这意味着须搭配超高毒性的Payload,但考虑到Enhertu和Trodelvy的成功,未来的发展趋势或许是高DAR+中等毒性的Payload组合。
DM1与Auristatin类比较
:
在微管蛋白抑制剂中,DM1和Auristatin均为经典的微管蛋白抑制剂,但由于MMAE/MMAF的细胞毒性强于DM1的细胞毒性,因此使用更加广泛。
在已上市的ADC药物中,仅T-DM1一款采用DM1,Adcetris、Polivy和Padcev采用MMAE,Blenrep采用MMAF。
Auristatin类比较
:从采用MMAE和MMAF的上市ADC药物不难发现,MMAE的适用性更广。这是由于MMAF可产生具有带负电荷的羧基末端苯丙氨酸残基的代谢物,无法跨膜发挥Bystander作用。
微管蛋白抑制剂与DNA抑制剂比较
:尽管微管蛋白抑制剂在ADC药物的设计中发挥了巨大的作用,但DNA抑制剂发展势头正盛。Enhertu和Trodelvy的巨大成功令科学家将目光投向这一领域。
DNA抑制剂较微管蛋白抑制剂相比,主要包括以下
优势
:
-
首先,癌细胞内微管蛋白数量较多而DNA异构酶数量较少,这导致微管蛋白抑制剂需要的剂量远超DNA抑制剂的剂量;
-
其次,微管蛋白在癌细胞中抑制剂作用时间较短(2h),而DNA抑制剂的作用时间可长达24h,更长效地发挥抗肿瘤作用;
-
最后,微管蛋白抑制剂抗癌谱较窄,对结直肠和胃肠道肿瘤活性较低,例如,对于HER2低表达的乳腺癌和胃癌,微管蛋白抑制剂表现不算理想。
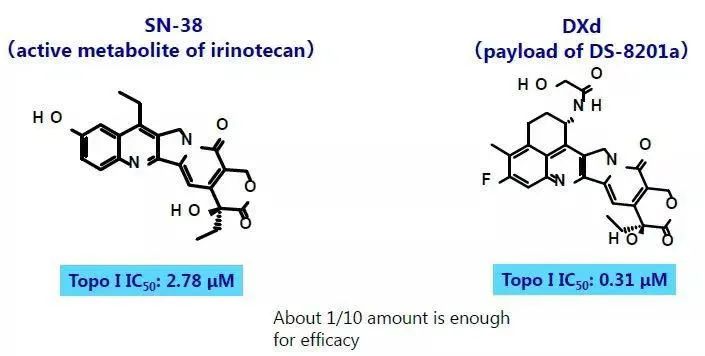
SN-38与DXd化学结构













