9月1日,上海阳光医药采购网在官网发布
《联盟地区药品集中采购文件》
(以下称文件),文件称,在国家组织药品集中采购和使用试点城市(以下简称4+7城市)及已跟进落实省份执行集中采购结果的基础上,国家组织相关地区形成联盟,依法合规开展跨区域联盟药品集中带量采购。

一个品种可多家中标
《文件》明确,此次联盟地区包括山西、内蒙古、辽宁、吉林、黑龙江、江苏、浙江、安徽、江西、山东、河南、湖北、湖南、广东、广西、海南、四川、贵州、云南、西藏、陕西、甘肃、青海、宁夏、新疆(含新疆生产建设兵团),联盟地区4+7 城市除外。
这也意味着,全国34个省级行政区域,除去港澳台和4个直辖市(4+7试点城市),剩余27个省份全部跟进了“4+7”。
同时,《文件》提出,各地区委派代表参加联合采购办公室(简称联采办),代表联盟地区公立医疗机构、部分军队及社会办医疗机构等实施部分药品及相关服务的集中带量采购,由上海市医药集中招标采购事务管理所承担日常工作并具体实施。
这也意味着,与首轮采购相比,采购主体不再限于公立医疗机构,有分析人士表示,将社会办医疗机构纳入采购主体,意味着采购量的扩大,对企业来说,是更大的利好。
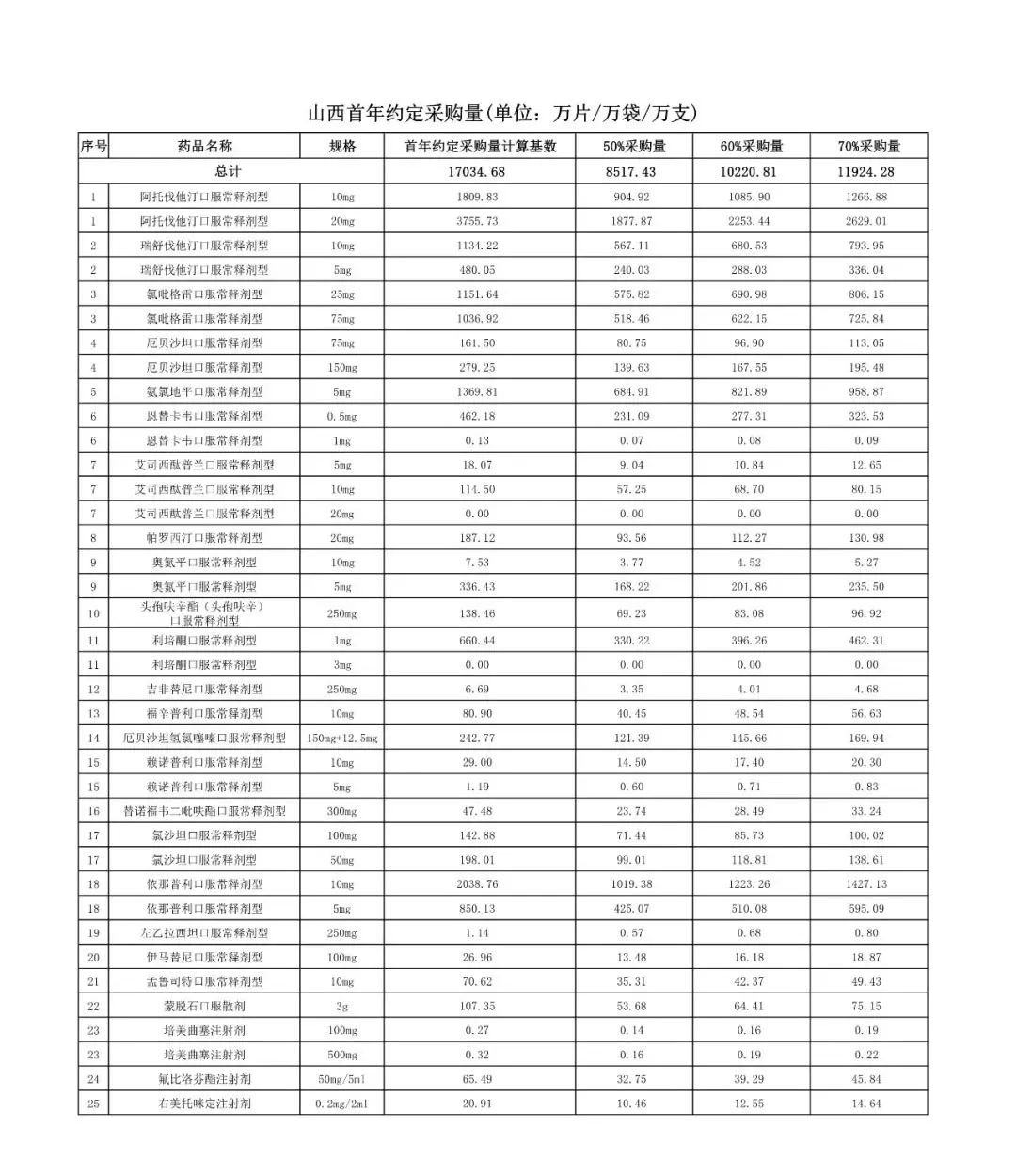
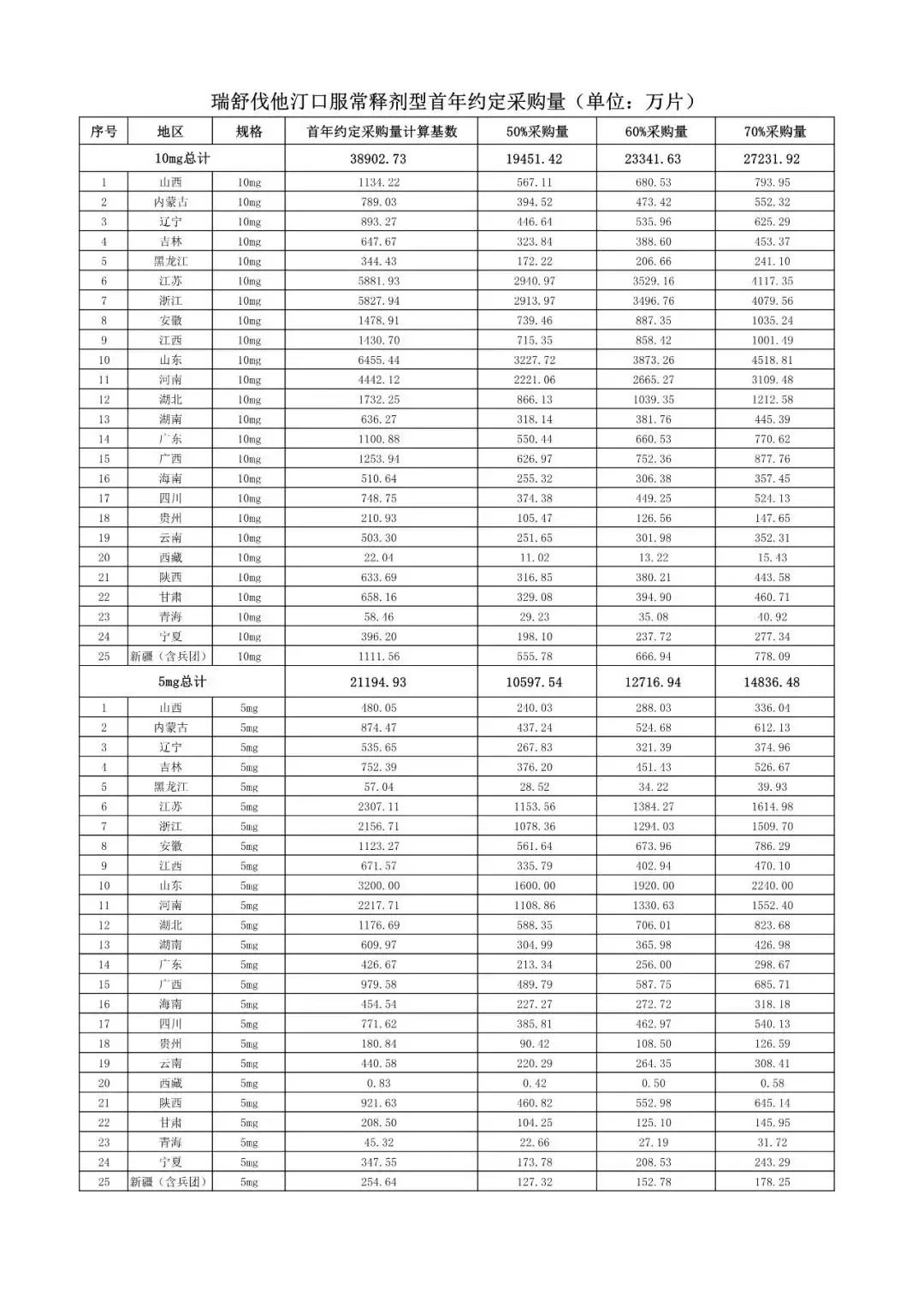
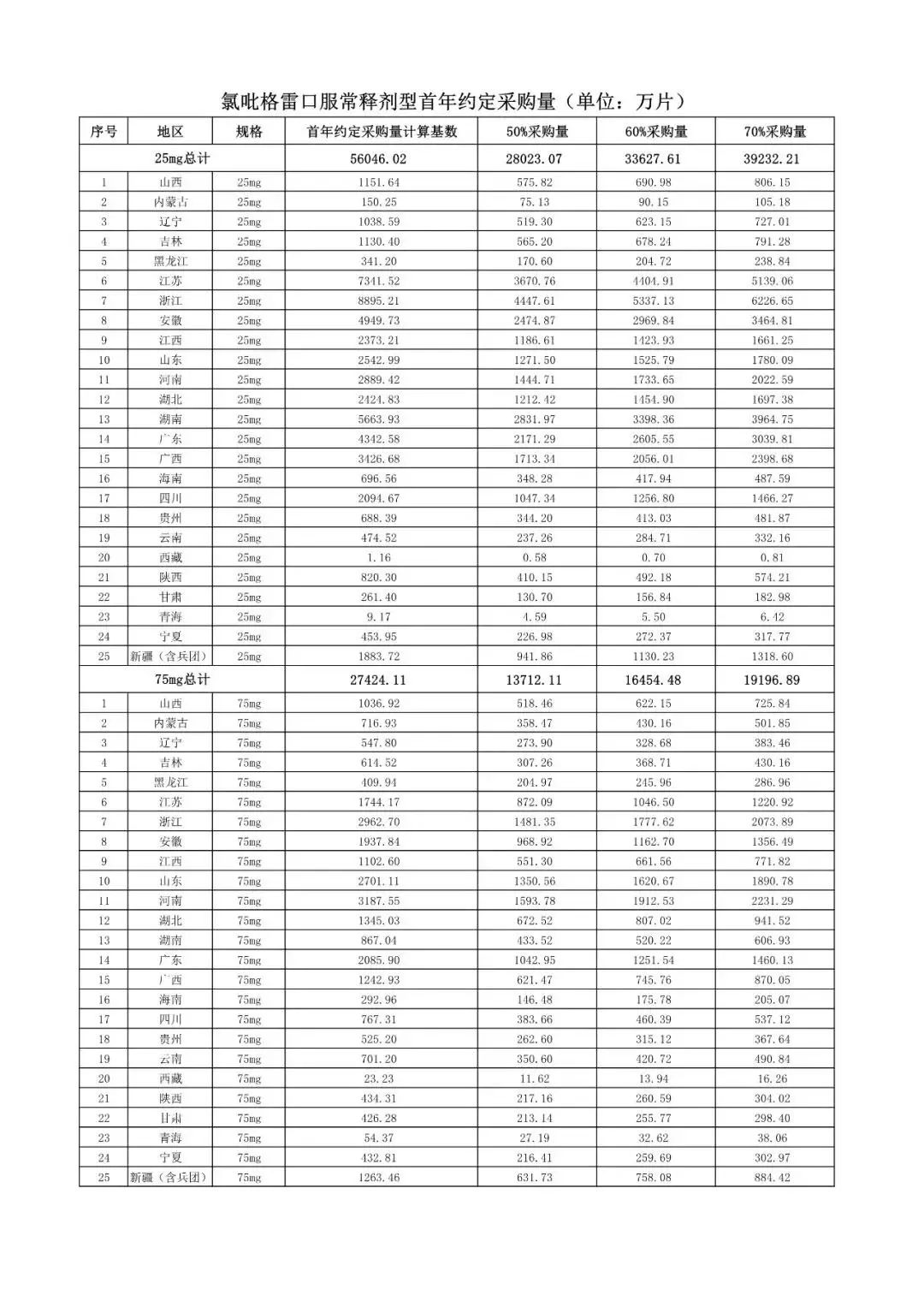
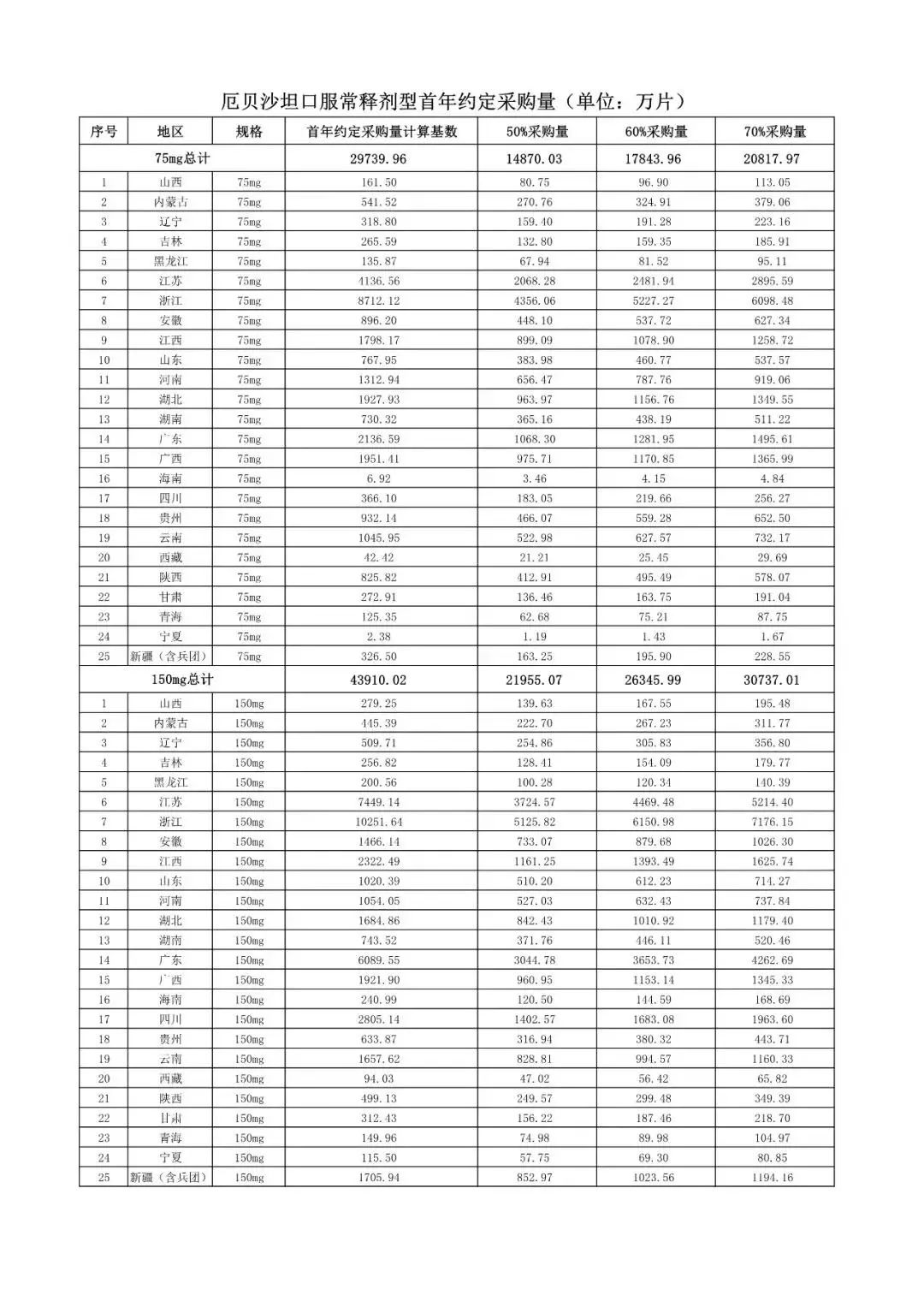
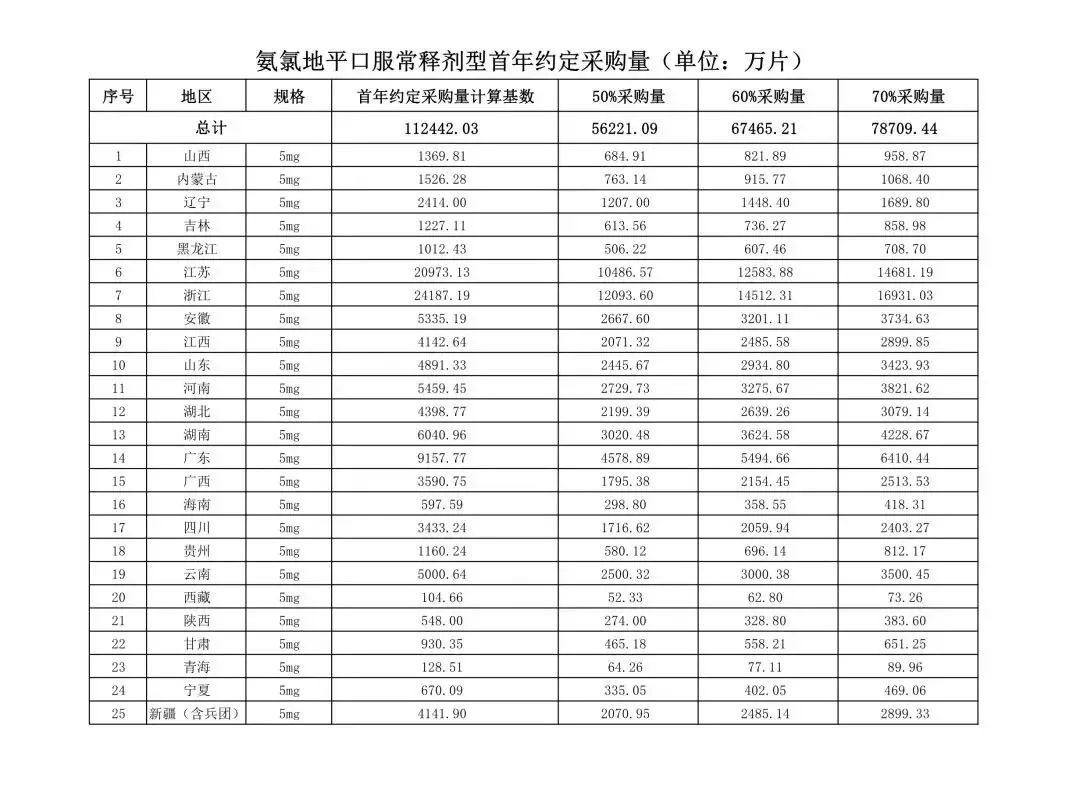
在备受关注的采购品种及约定采购量方面,《文件》明确,采购品种为阿托伐他汀口服常释剂型等25个品种。
根据《文件》,此次集中采购药品首年约定采购量计算基数由各联盟地区确定。
全国实施25个品种的带量采购
4
+7扩面,继续由上海药事所来具体实施。
文件公布了各省的首年约定采购量,医药云端工作室根据首年约定量的基数(注意,此处不是采购量),统计了各省大致的采购份额,如下表所示:
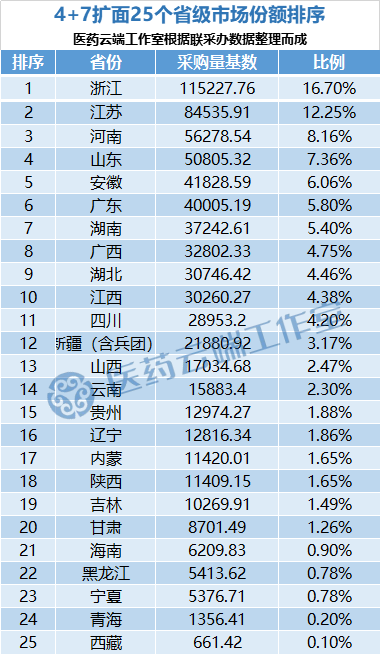
如上表所示,浙江、江苏的约定量基数占25个省总量的比例均超过10%,浙江排第一,超过了第二名江苏四个百分点,江浙不愧为国内经济发达医疗资源丰富的大省。而河南、山东则是人口过亿的大省,份额接近;安徽的份额能排在第5位,这一点有点出乎意料;而广东在排除广州、深圳两大试点大城市之后,份额仅为5.8%,排在第6位。
海南、黑龙江、宁夏、青海、西藏的份额均未达到1%,排在最后。其中黑龙江的采购份额位列居后,出乎意外。
独家、2家、3家中标分别获取50%、60%、70%的份额
实施的品种为4+7集采的25个中选品种,采购文件公布了这些品种首年的约定采购量,并按50%、60%、70%的比例显示具体的数量,这一比例将根据集采最终的中标情况,分别按独家、2家、3家中标的结果来获得相应的采购份额。(即独家中标获得50%份额、2家获得60%、3家获得70%份额)。
中选企业不超过2家(含)的品种,本轮采购周期原则上为1年;中选企业为3家的品种,本轮采购周期原则上为2年。采购周期视实际情况可延长一年。协议一年一签。
采购期内确保完成用量,超过部分仍按中选价供应,剩余用量可选择原中标其他品种
上述采购量,文件规定在集采结果执行周期中,医疗机构将优先使用中选品种,并确保完成约定采购量。
采购周期内若提前完成当年约定采购量,超过部分中选企业仍按中选价进行供应,直至采购周期届满。
完成采购量之后,剩余用量可按所在地原采购项目的规定适量采购同品种价格适宜的其他药品。
保证供应是采购的前提
关于申报条件,保证供应是前提,写在了第一条中,可见联采办对保供的重视。毕竟扩面后采购量在4+7基础上放大若干倍,难免有断供的情况发生。(河北跟标4+7后曾发生福辛普利钠原研厂家产能问题,最后紧急采购以华海补缺)。
各中选企业应每月向联采办报送中选药品的库存数量,在采购周期内,中选企业出现无法供应情况,致使协议无法继续履行时,联采办组织该品种联盟地区未中选企业确定替补的供应企业。因保障供应产生的额外支出由该无法履行协议的企业作为第一责任人承担。
对于申报品种的条件,满足以下其中一条就可申报:
1、原研药品及参比制剂
2、通过一致性评价仿制药
3、按化学药品新注册分类批准的仿制药品
4、纳入《中国上市药品目录集》的药品。
企业在申报品种时必须包含采购品种目录指定的主品规,常用包装。
9月24日上午十点前递交资料,下午两点开始确定供应地区
9月24日(星期二)上午八点半开始接收申报材料,当天上午十点递交截止。然后十点开始公开申报信息,下午两点进行供应地区确认。
报价及限价规则:4+7中选价及省级最低中标价是天花板价格,实施差比价规则换算
申报价不应高于4+7中选药品按现行药品差比价规则折算后的价格,且原则上不应高于本企业同品种2019年(截至7月31日)联盟地区省级集中采购最低价。
拟中选品种确定:报价最低的3家获得资格
满足限价的前提下,确定报价最低的3家企业获得拟中选资格(申报企业不足3家的,以实际为准)。获得拟中选资格的企业及申报品种,统一进入供应地区确认程序。
企业申报价格出现相同时,该品种按以下规则及顺序确定拟中选企业及供应地区确认的优先顺序:
(1)“4+7城市药品集中采购”中选的企业优先;
(2)2018年在联盟地区供应省(区)数多的企业优先;
(3)2018年在联盟地区销售量大的企业优先,多个规格的品种,销售量合并计算;
(4)原料药自产的企业优先(限指原料药和制剂生产企业为同一法人);
(5)通过或视同通过国家药品监督管理局仿制药质量和疗效一致性评价时间在前的企业优先(以国家药品监督管理局批准日期为准)。
供应地区确认:
按申报价格由低到高依次交替确认供应地区
获得拟中选资格的企业及申报品种,统一进入供应地区确认程序。
拟中选企业应结合本企业产能确认供应地区。
拟中选企业按申报价格由低到高(当价格相同时按11.2条确定顺序)依次交替确认供应地区,每个拟中选企业每次选择一个省(区),重复上述过程,直至所有省(区)选择确认完毕。
拟中选企业轮到选择时必须做出确认,不得弃权,否则视同放弃拟中选资格
,由符合申报条件的企业根据拟中选品种确定准则依次递补并重新确认供应地区;若无符合条件的递补企业,由其他拟中选企业按顺序重新依次确认供应地区。
中选品种确定:
按照拟中选结果公示、中选通知、签订购销协议的流程走
各联盟地区按扩大集中采购覆盖范围工作要求,就购销协议、药品配送、质量检测、未中选品种价格调整、医保支付标准等事项发布补充文件。
来源:医谷、医药云端工作室
附联盟地区药品集中采购文件
附采购品种首年约定采购量
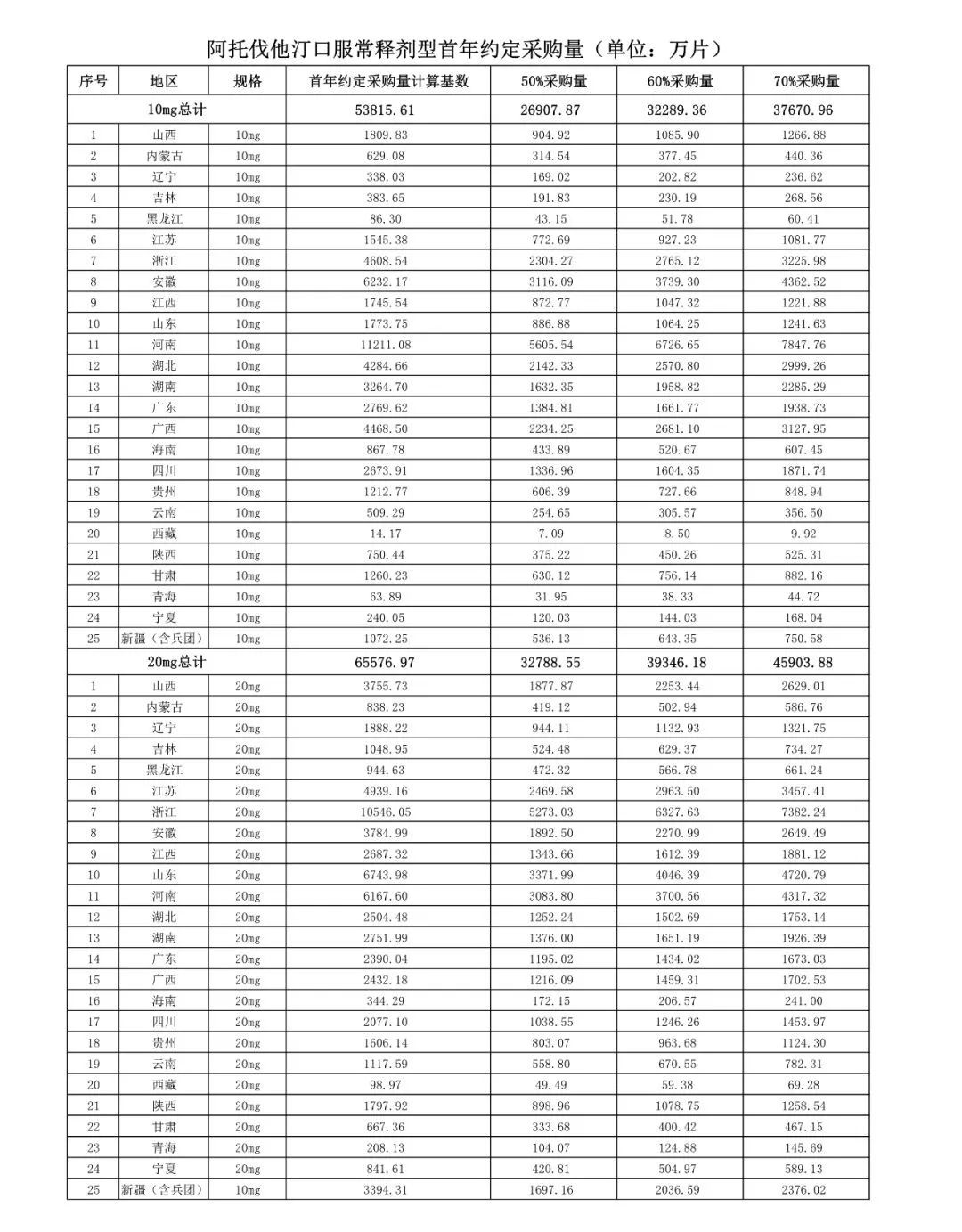
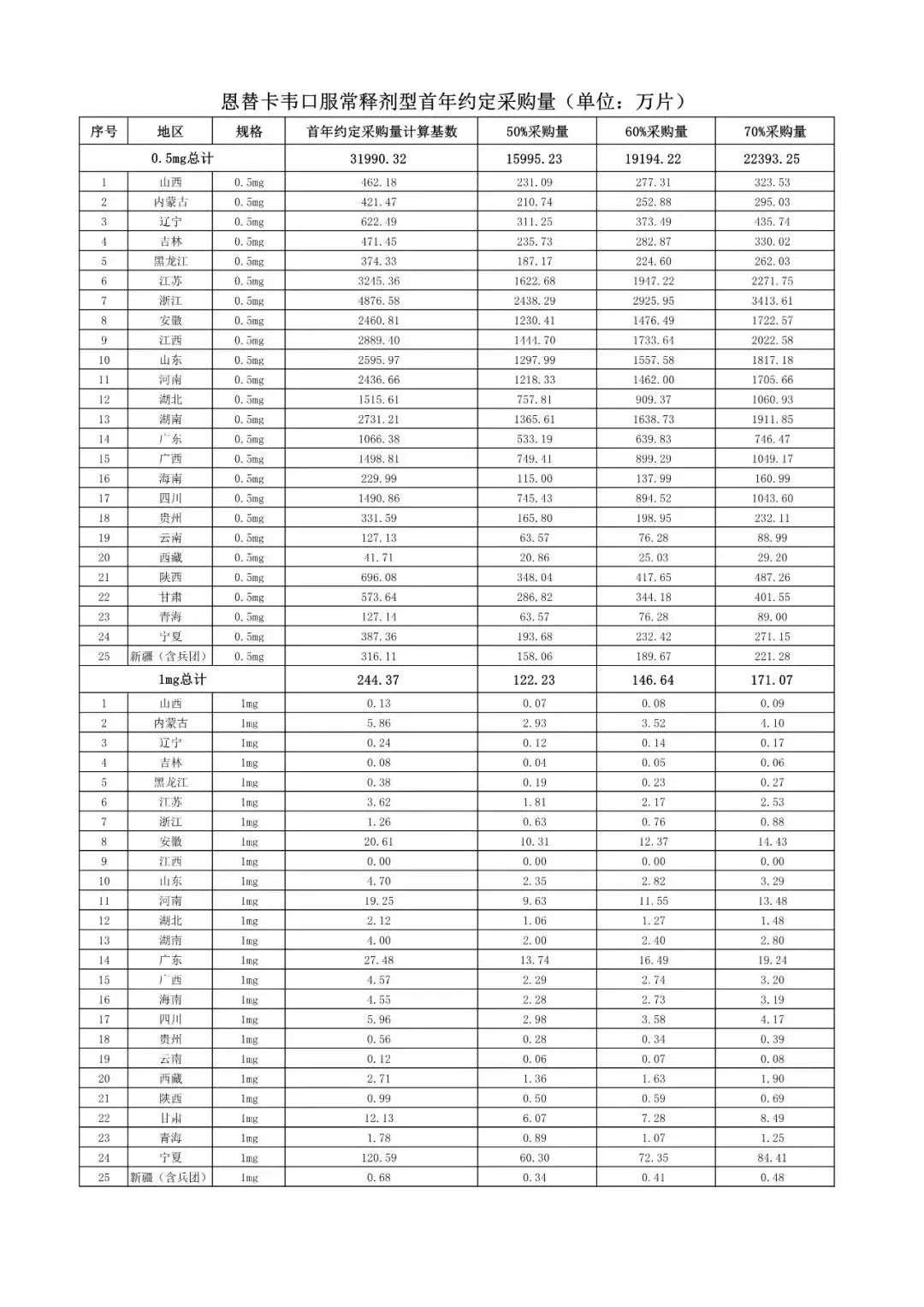





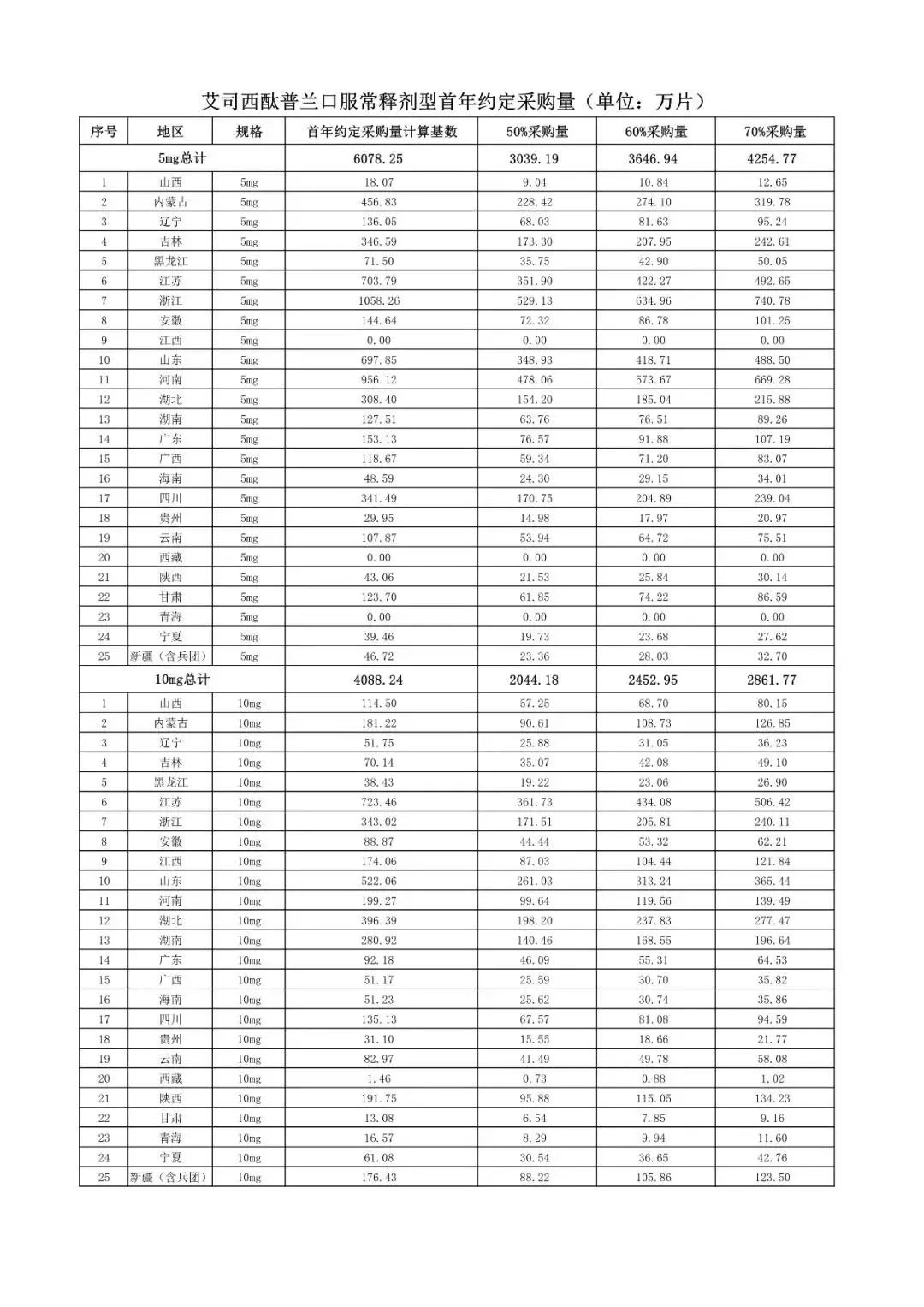


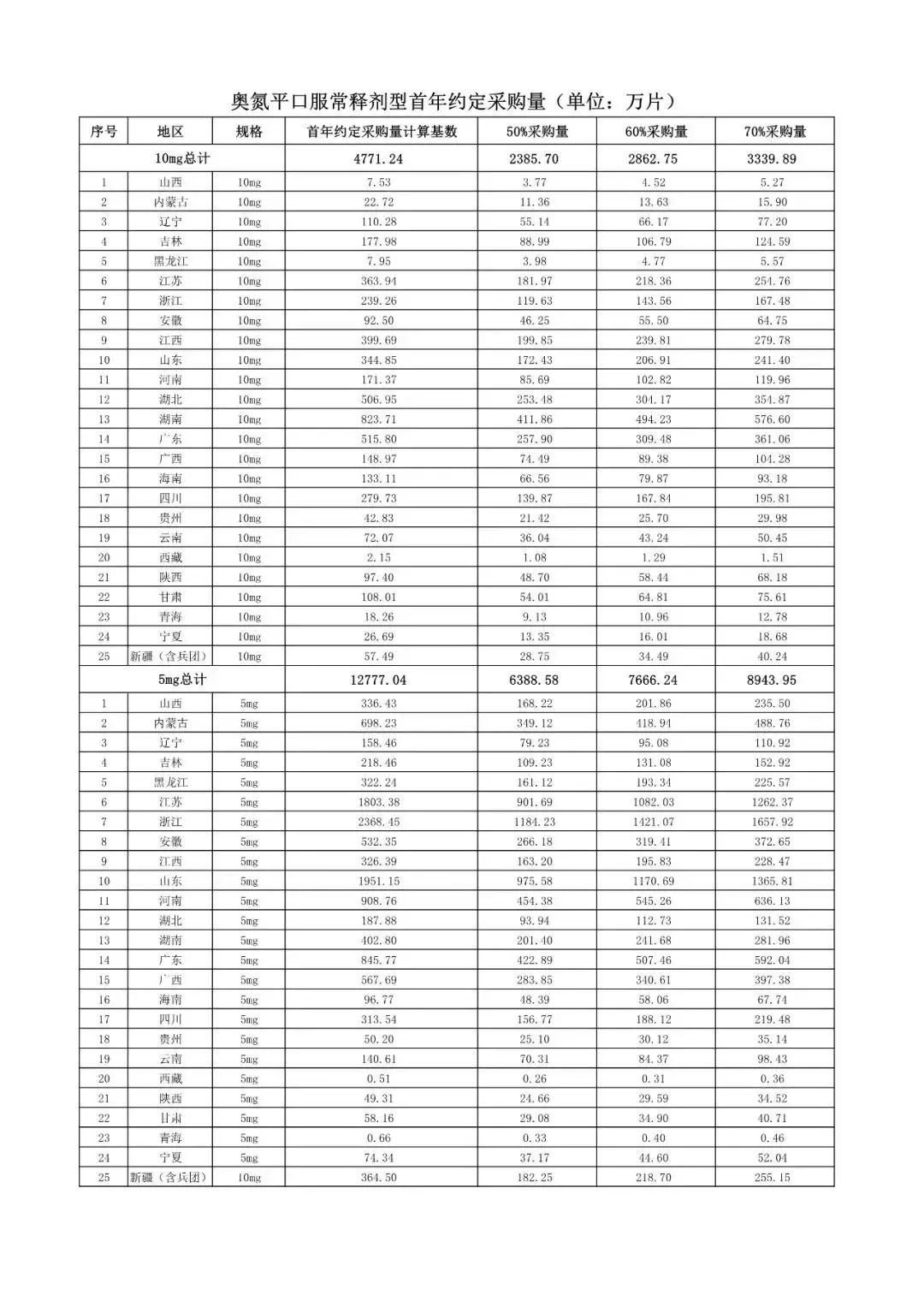
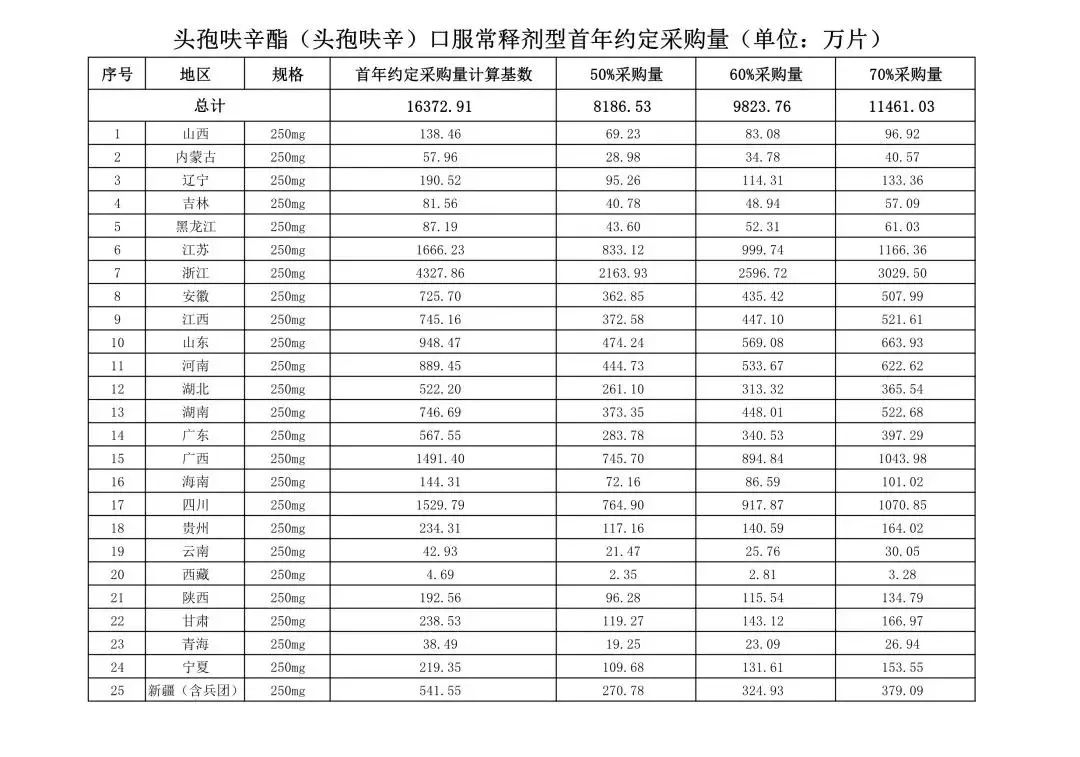
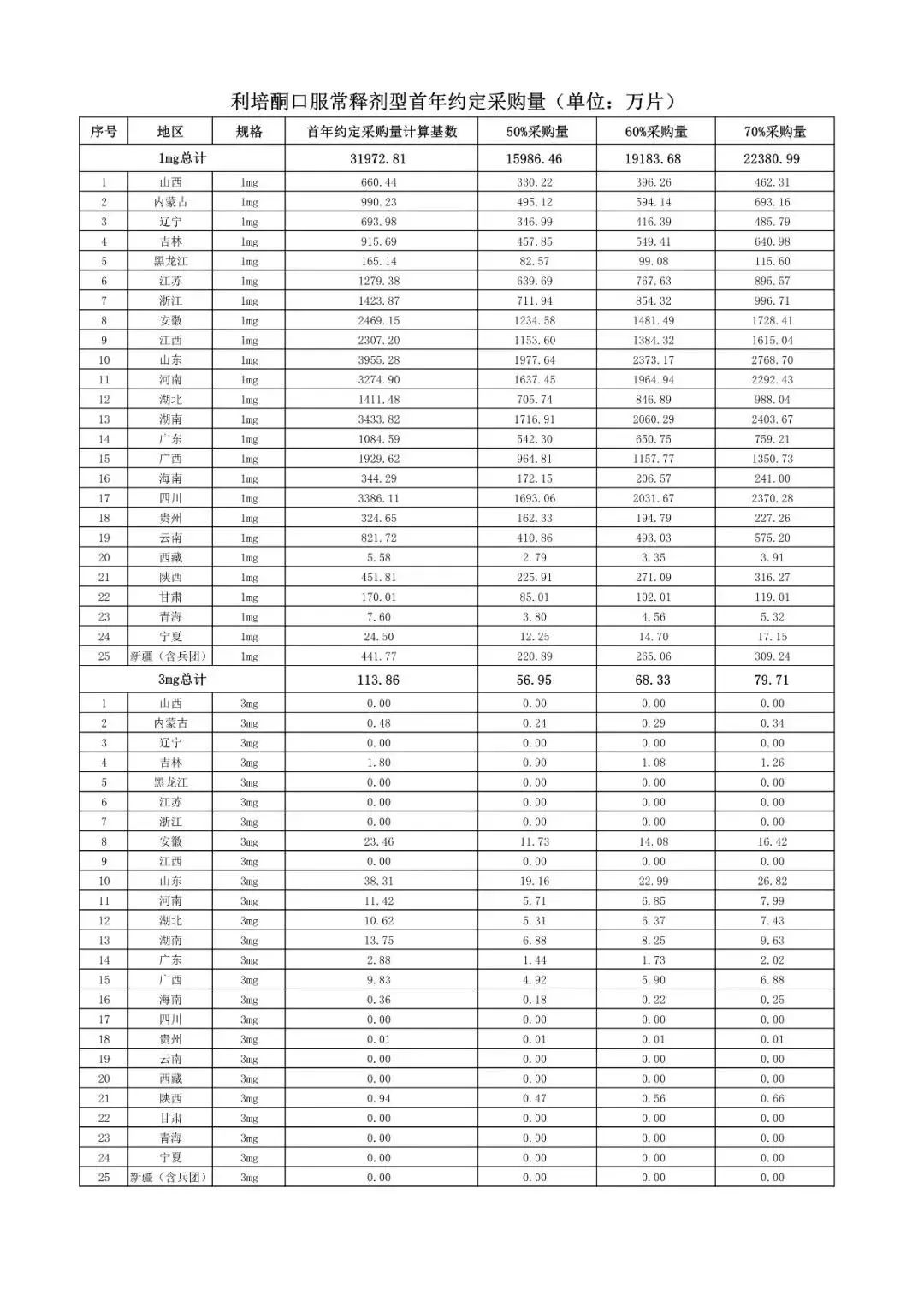
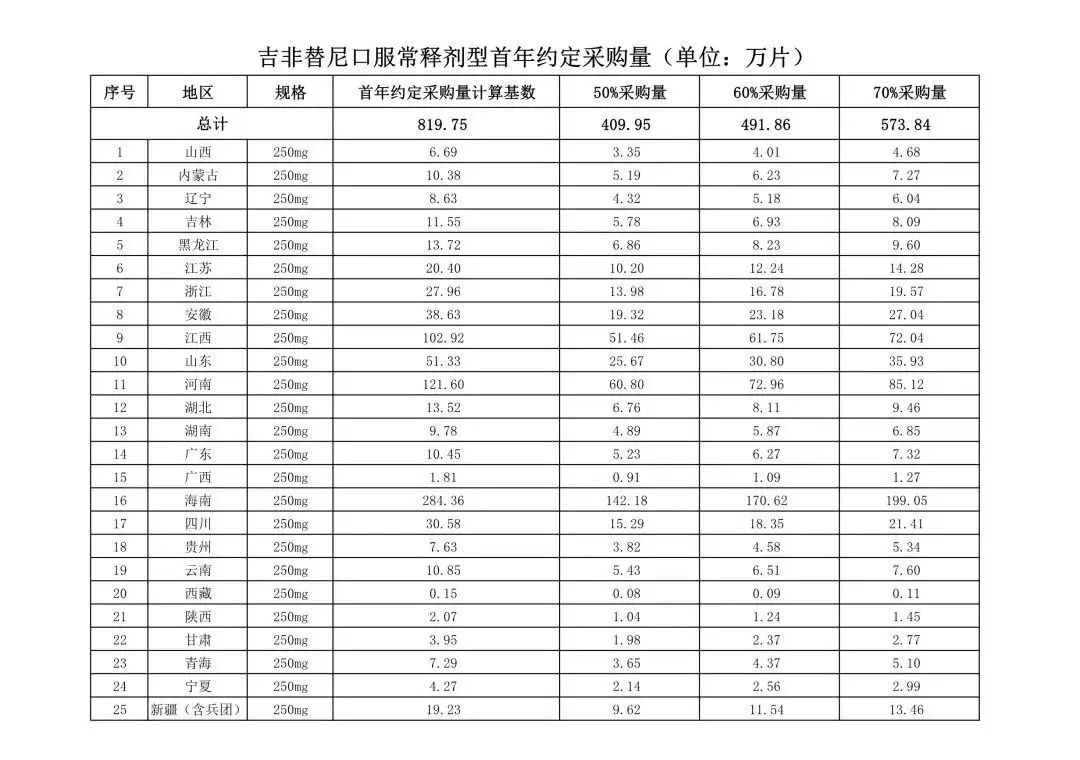
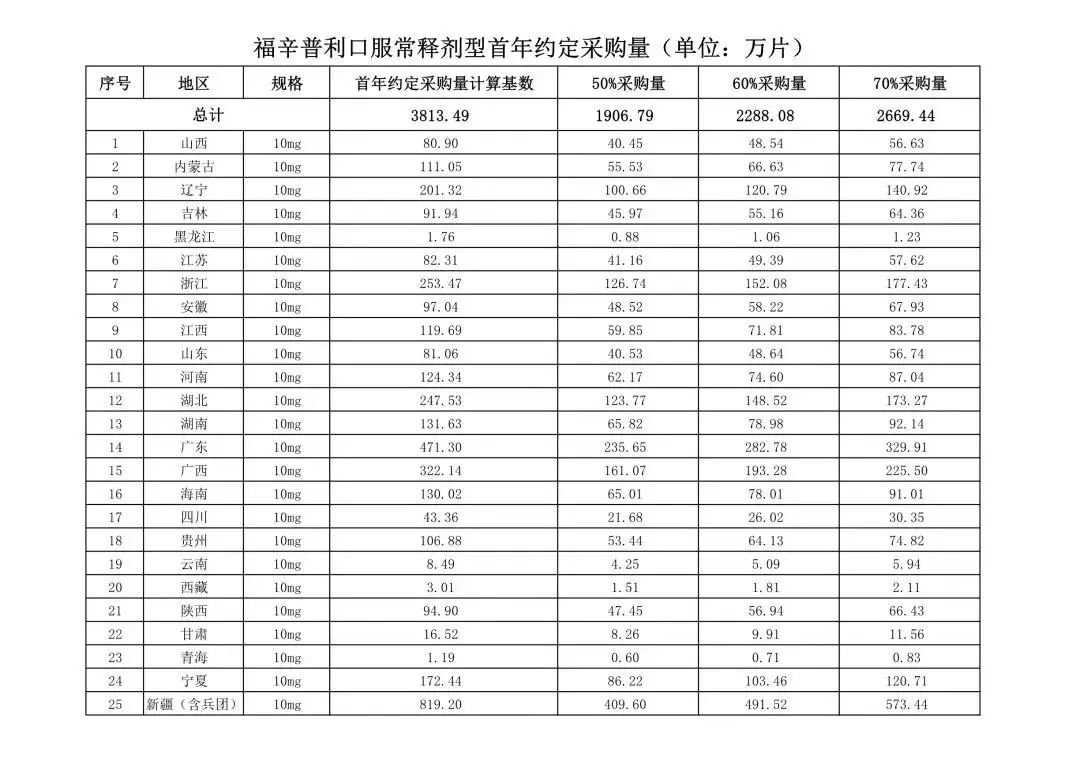
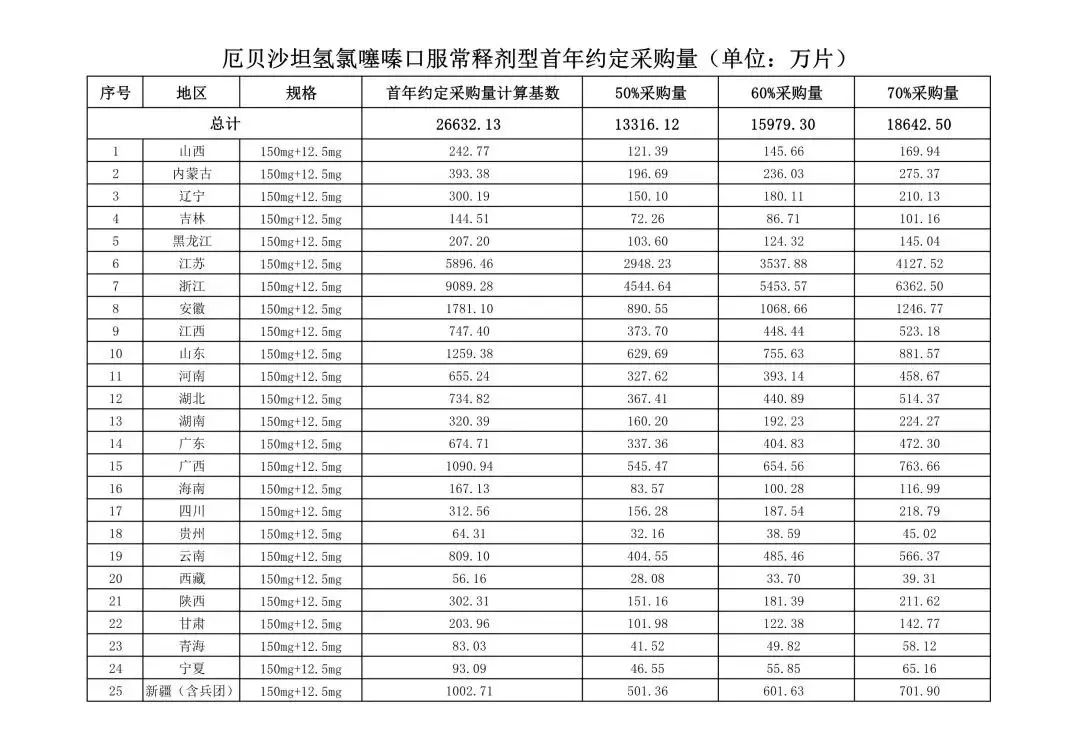
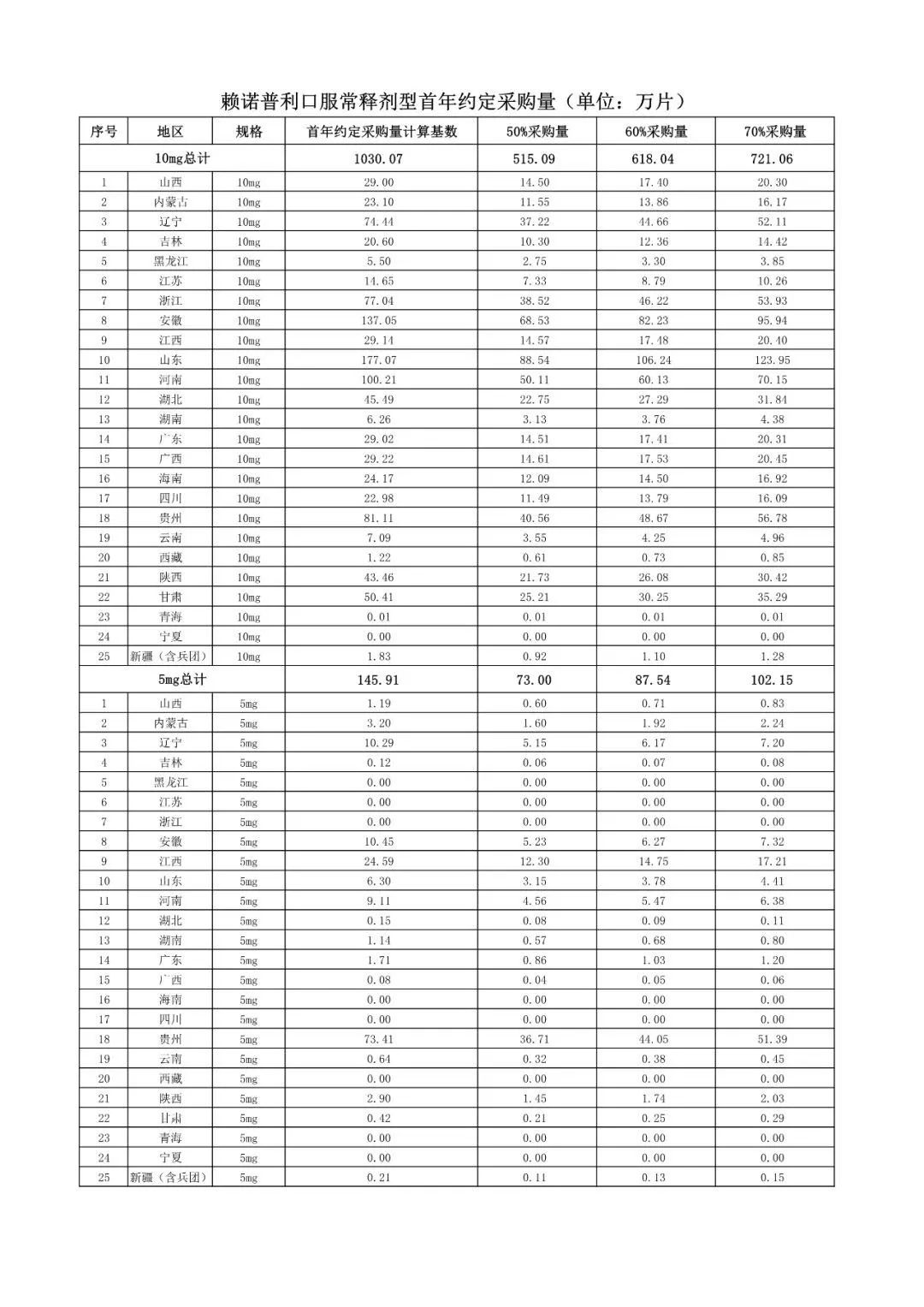
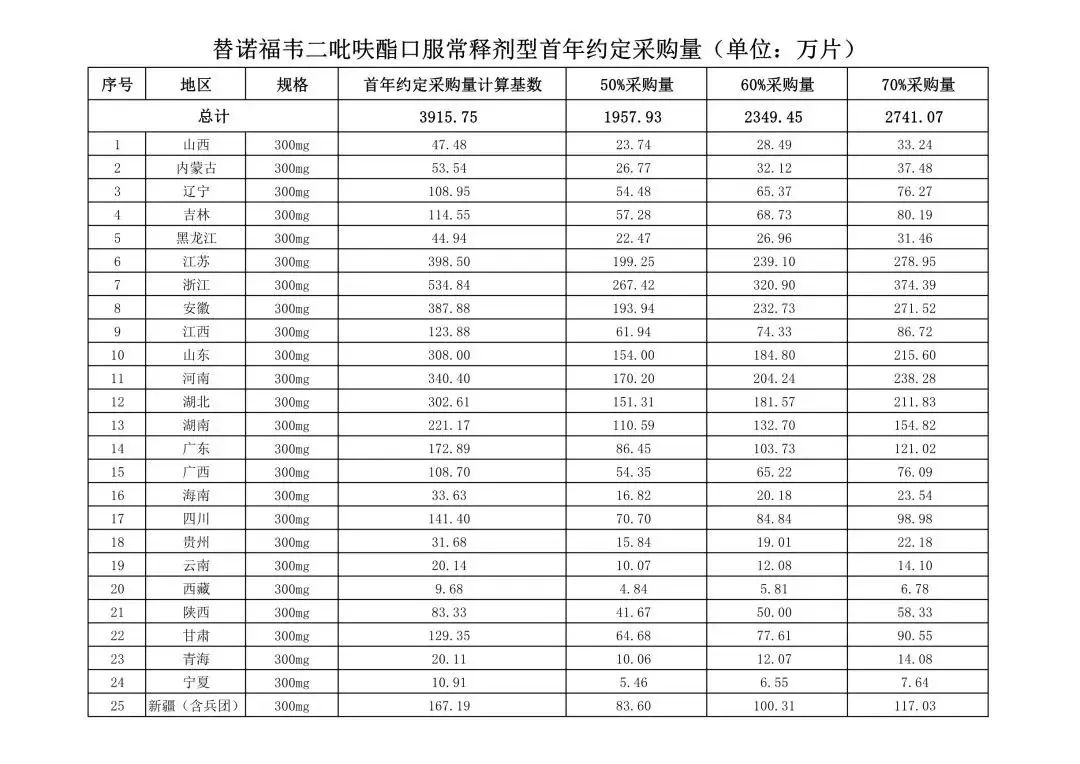
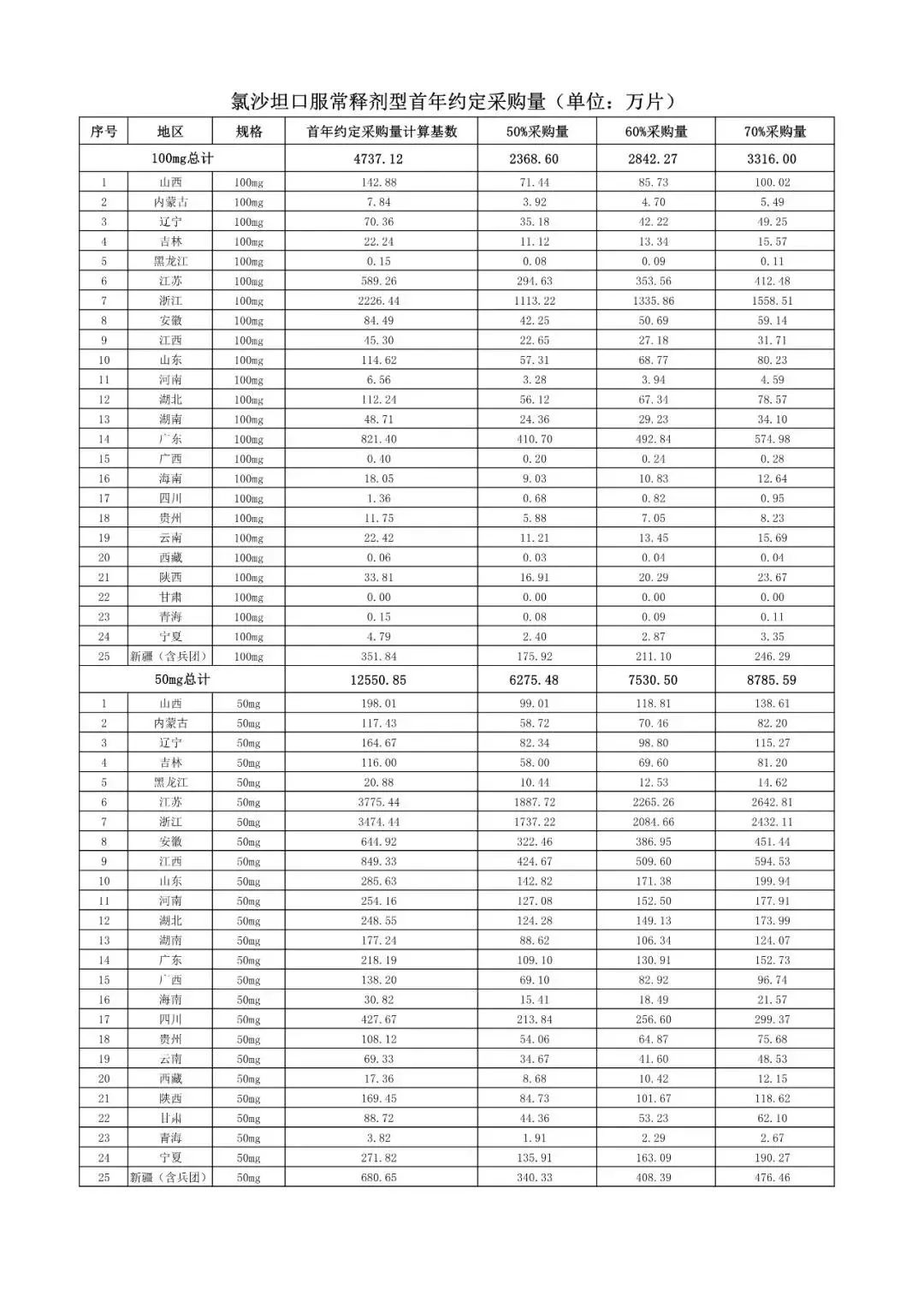
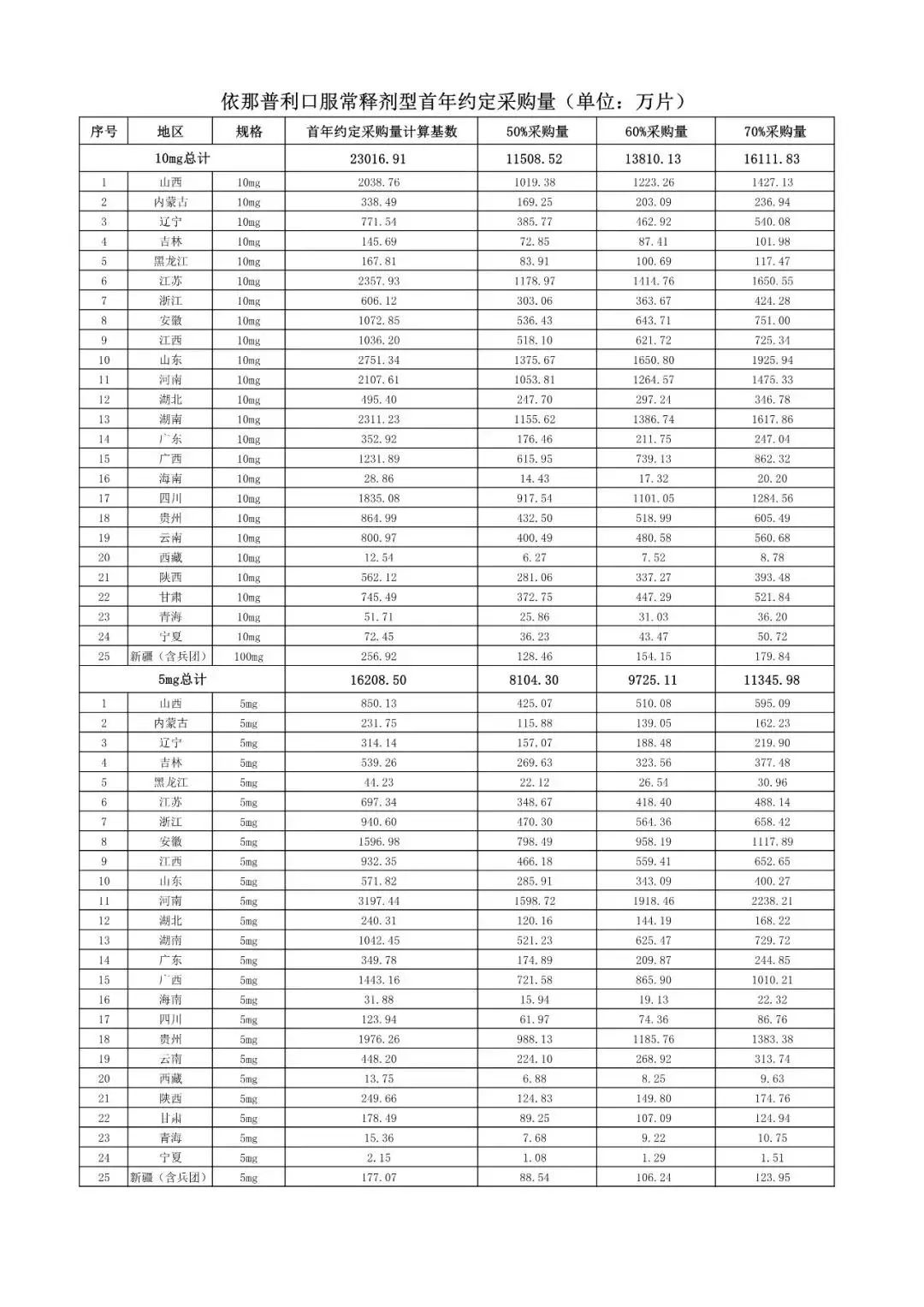
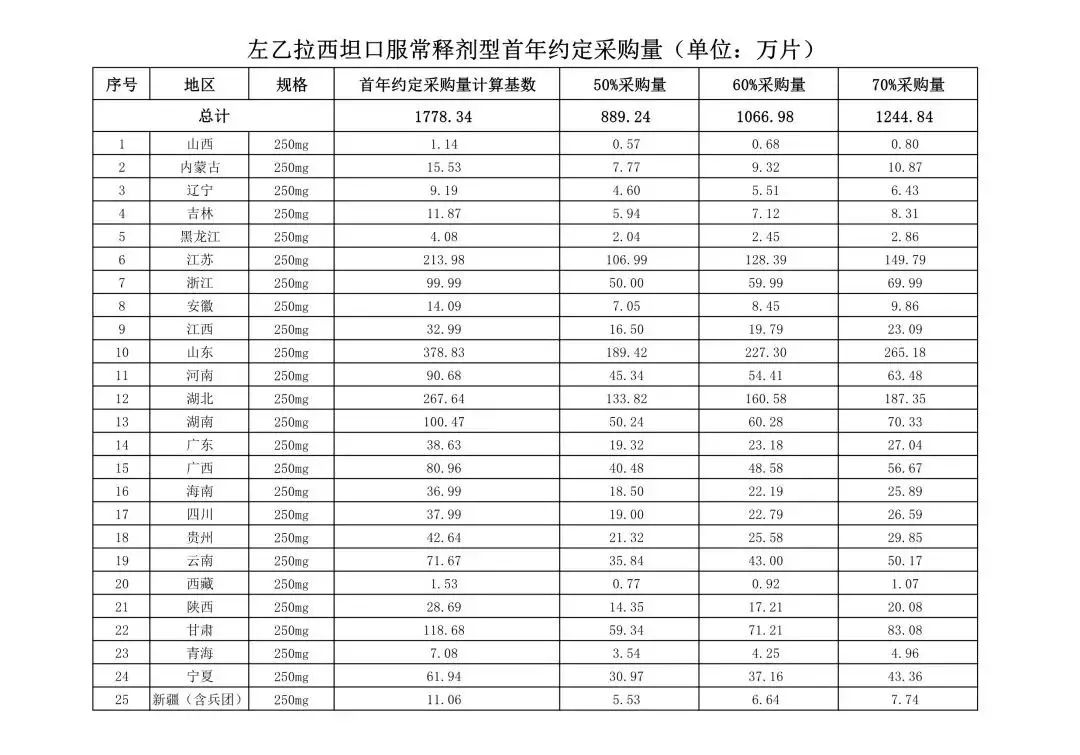
附联盟地区首年约定采购量