Tiziana的Foralumab治疗非酒精性脂肪性肝的预临床试验取得成功
7月28日,英国,Tiziana Life Sciences plc公司今日宣布该公司在著名的《Clinical Immunology》杂志上发表了一篇题目为《Oral treatment with foralumab, a fullyhuman anti-CD3 monoclonal antibody, prevents skin xenograft rejection inhumanized mice》的研究性文章。这篇文章第一次公开报道了该公司在研发药物Foralumab (NI-0401)对于非酒精性脂肪肝等炎症性疾病具有较好的疗效。Tiziana的Foralumab是目前唯一以口服方式给药的进入临床研究阶段的完全人源化靶向CD3的单克隆抗体。
非酒精性脂肪性肝炎是一种严重的非酒精性脂肪性肝病,是脂肪肝的一种,表现为肝脏中的脂肪沉积,随后引起肝细胞损伤和肝脏炎症。炎症的持续作用,最终会引起门静脉高压、发展为肝硬化、肝癌等严重病症。根据最新的市场研究报告显示,至2025年非酒精性肝炎预计会有195亿美元的药物市场需求。
Foralumab是一种能够高效结合CD3的具有长半衰期的单克隆抗体候选药物。此项预临床研究证实,口服给药具有同样高效的治疗疗效,同时Foralumab也显示出了治疗非酒精性肝炎、糖尿病和自身免疫性疾病的潜在疗效,有可能成为未来满足临床需求的新选择。
Galderma公司的Nemolizumab治疗过敏性皮炎的2期临床试验正式开始
8月25日,瑞士,Galderma公司今日宣布该公司正在开展的一项Nemolizumab治疗过敏性皮肤炎(atopicdermatitis , AD)的2期临床数据已经有第一位病人入组接受试验。这是一项多中心双盲对照试验,旨在评价Nemolizumab对于中重度AD的有效性和安全性以及相关的药代动力学参数。
过敏性皮炎是一种慢性炎症性皮肤病,常以湿疹形式显现,同时也会伴随有皮肤干燥、红肿、肿胀、瘙痒等主要症状。患者常在儿童期开始发作并表现相关症状,且疾病会持续到成年期。疾病的持续发作虽不会危及生命,但对患者及其家属的睡眠和生活质量产生非常严重的影响。AD的病因目前还不完全清楚,但可能涉及多种遗传、免疫和环境因素。
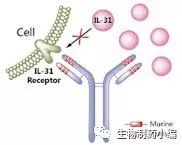
Nemolizumab是一种靶向IL-31受体的单克隆抗体,可以有效阻断IL-31与其受体的结合,阻断随后的信号转导。IL-31作为一种促炎因子,在AD的炎症反应中起关键作用。
Amgen关于Repatha®(Evolocumab)的补充材料生物许可申请获得FDA优先评审资格
7月27日,美国,Amgen公司近日宣布其已经向FDA递交了有关Repatha® (Evolocumab)减少心血管事件的补充证明材料,且FDA给予其优先审批的资格。
Repatha® (Evolocumab)还是一种PCSK9 inhibitor抑制剂,目前已经被批准用于家族性高胆固醇血症的治疗,可以显著降低血液中LDL水平。此次的补充数据是基于一项大型临床研究,研究显示Repatha® (Evolocumab)的治疗在不增加药物安全性相关风险的同时,可以显著降低患者的心血管事件风险。
Boehringer Ingelheim开展了一项仿制药Adalimumab与HUMIRA®的替换性研究
7月27日,德国,Boehringer Ingelheim公司今日宣布其正在开展的VOLTAIRE-X interchangeability研究已经有第一个病人入组。此项研究旨在评估其仿制药Adalimumab对于现有药物HUMIRA®的可替换性,其主要的评价指标包括药物的药代动力学参数和其临床疗效,其它指标还包括药物的安全性和免疫原性等。
Compugen的免疫检查点调节剂CGEN-15001T获得拜耳的支持将进一步推进研发工作
7月27日,以色列,Compugen公司今日宣布其将进一步推进其与拜耳公司基于肿瘤免疫治疗的合作。此项合作的后续将会推动Compugen研发的两个免疫检查点调节剂CGEN-15001T 和CGEN-15022的进一步研究和商品化。但是目前已有的数据显示CGEN-15022的抗肿瘤活性并不显著,所以后续的合作主要还是会集中于CGEN-15001T上。
AstraZeneca公布了有关晚期肺癌的初步临床数据
7月27日,英国,AstraZeneca今日宣布其正在进行的Imfinzi(Durvalumab)治疗晚期转移性肺癌的临床试验已经有了初步的结果。这是一项全球多中心、随机、开放的研究,旨在评价Imfinzi (Durvalumab)或Imfinzi (Durvalumab)联合Tremelimumab VS顺铂标准疗法在治疗晚期转移性肺癌方面的疗效。实验数据显示,两组在患者无进展生存周期方面无显著差别,其它次要临床终点也未能达到。该项试验还将进一步评估患者的总生存率,预计最快将会在2018年有结果。
OncoQuest公司的Oregovomab联合Hiltonol®治疗复发性卵巢癌的临床试验正式开始
7月26日,加拿大,OncoQuest公司今日宣布该公司一项Oregovomab联合Hiltonol®治疗复发性卵巢癌的临床试验已经有第一位病人入组治疗。这项1/2期临床试验旨在评估Oregovomab联合其它药物对治疗软复发性卵巢癌的疗效。
Oregovomab是一种具有高亲和力的能够靶向肿瘤相关抗原CA125的单克隆抗体药物,抗体与靶位的结合随后会诱导一系列免疫联级反应杀伤肿瘤细胞。CA125在卵巢癌细胞表面过表达,但同时也会有部分抗原分泌进入血液循环。OncoQuest公司的数据显示Oregovomab联合卡铂化疗可以增加疗效使患者获益,目前公司正在进一步拓展关于晚期卵巢癌的治疗。
ORENCIA的第二个适应症银屑病性关节炎在欧洲获批
6月26日,美国,BMS公司今日宣布该公司的ORENCIA获得欧洲委员会的批准用于单药治疗或者联合methotrexate治疗活跃性银屑病性关节炎。此项适应症的获批极大的拓宽了ORENCIA的市场,同时这也是ORENCIA暨风湿性关节炎以后在不到一年的时间内获得的第二个适应症。
此项适应症的获批是基于两项随机双盲对照研究,试验数据显示相较于对照组ORENCIA治疗所获的主要临床终点比例更高(47.5% VS 19.0%)。
DE-122联合Lucentis®(Ranibizumab)治疗AMD的临床试验即将开展
7月25日,美国,Santen Pharmaceutical和TRACON Pharmaceuticals公司今日宣布其已经证实启动了一项2期临床研究评价DE-122治疗年龄相关黄斑变性(AMD)的临床疗效。这项随机对照试验主要比较在AMD治疗过程中,DE-122联合Lucentis® (Ranibizumab)疗法是否优于Lucentis® (Ranibizumab)单药治疗。此项试验的开展一方面给AMD的治疗带来一种新的机制,同时对于Lucentis® (Ranibizumab)来说也是其拓宽适应症的一个机会。
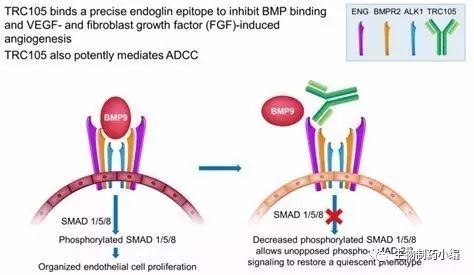
DE-122(TRC105)是一种靶向内皮糖蛋白的抗体药物,内皮糖蛋白在增殖的内皮细胞中过表达,是血管生成的重要参与者。目前该药物正用于抗肿瘤的临床试验中。
AMD是老年人失明的一个主要因素,包括针对VEGF治疗策略在内的现有疗法远不能满足临床需求,新药或新疗法的研发迫在眉睫。
BMS向FDA递交了跟新Opdivo (Nivolumab)给药方式的生物许可申请
7月24日,美国,BMS公司近日宣布FDA已经受理了Opdivo (Nivolumab)的补充生物许可申请。此次的补充申请,BMS更新了Opdivo (Nivolumab)针对所有适应症的单药治疗的给药方式(480 mg infused over 30 minutes every fourweeks,Q4W)。
KEYTRUDA® (Pembrolizumab)治疗头颈癌的3期临床未获得主要终点
7月24日,美国,Merk公司今日宣布该公司开展的一项KEYTRUDA® (Pembrolizumab)治疗复发或转移性头颈部鳞状细胞癌的3期临床试验未获得主要终点,其患者的总生存率无显著改善。这是一项随机、多中心的3期临床试验旨在评价KEYTRUDA® (Pembrolizumab)单药治疗与目前标准疗法的差异,患者的总生存率是主要临床终点。数据显示包括在OS。PFS等各项指标上,KEYTRUDA® (Pembrolizumab)的单药治疗相较于标准疗法都没有获得明显改善。
UCB和Dermira申请拓宽CIMZIA适应症用于银屑病的治疗
7月25日,美国,Dermira和UCB公司今日宣布其已经向美国俄欧盟分别递交了补充生物许可申请以拓宽CIMZIA适应症用于中重度斑块状银屑病的治疗,同时向加拿大提交同样申请的工作也在稳步推进中。
此项拓宽适应症的申请基于三项临床研究,数据显示CIMZIA的治疗可以显著改善患者的症状,减轻患者负担,与此同时药物的安全性也得到了进一步的确认。此前该药物已经批准用于类风湿性关节炎的治疗。
Seattle Genetics开展有关三阴性乳腺癌的新研究
7月24日,美国,Seattle Genetics公司今日宣布与Genentech达成合作计划,将开展一项研究以评估抗体药物偶联物SGN-LIV1A联合Atezolizumab (TECENTRIQ®)治疗转移性三阴性乳腺癌(TNBC)的疗效。乳腺癌是常见的妇科癌症,每年全球会新增170万例患者,其中约有20%是乳腺癌三阴性。
SGN-LIV1A是一种新型的靶向LIV-1蛋白的抗体药物偶联物,LIV-1在转移性乳腺癌细胞的表面大量表达。SGN-LIV1A由靶向LIV-1蛋白的单克隆抗体和微管破坏药物组成,当该药物进入体内,可以靶向表达先关蛋白的肿瘤细胞,并释放毒性物质杀伤肿瘤,从而起到抗肿瘤的目的。同时其还可以激活相关的抗肿瘤免疫反应,只是相关机制仍不清楚。
Pfizer研发的Avastin®(Bevacizumab)仿制药PF-06439535的比较性试验获得主要临床终点
7月24日,美国,Pfizer公司近日宣布其研发的Avastin® (Bevacizumab)仿制药PF-06439535的临床疗效比较试验获得成功。实验数据显示在治疗非小细胞肺癌方面仿制药的客观反映率(ORR)与对照药物一致,显示二者临床疗效等效。
PF-06439535是Avastin®(Bevacizumab)的仿制药,Avastin在美国和欧洲各国上市用于非小细胞肺癌和结肠癌的治疗。作为仿制药,PF-06439535还没有上市,相关的生物等效性试验等工作还在稳步推进中。
FDA拓宽了Yervoy ®(Ipilimumab)的使用人群
7月24日,美国,BMS公司FDA已经拓宽了Yervoy ® (Ipilimumab)适应症用于12岁以上患者的转移性黑色素瘤的治疗。此项适应症的获批是基于两项儿童患者的临床试验,试验结果显示药物基于儿童患者的安全性与成年患者相当,而对于肿瘤的疗效也与成年患者的疗效相似。药代动力学的数据显示,12岁及以上的患者期临床给药的方式和剂量都无需做相应调整。结合新的审批结果,目前该药物已经被批准用于12岁以上患者的黑色素瘤治疗和存在淋巴结转移的黑色素瘤治疗。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:[email protected]

版权为生物制药小编所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:生物制药小编”。

坚持原创、坚持专业
欢迎关注生物制药小编
投稿信箱:[email protected]
小编团队现有13位成员:
Armstrong、医药局外人、Fairy、Jone、
东胜西牛、Alpharesearcher、MT、百草、
Irene、北望、蛋白工人、At.Zhou、Julia
欢迎有共同兴趣的朋友加入















