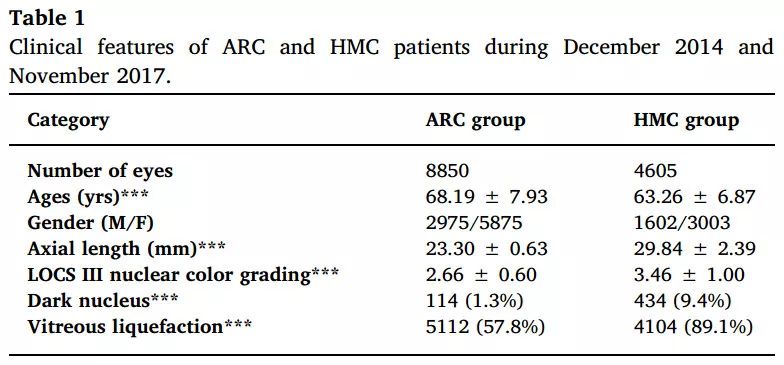
研究者通过对2014年12月至2017年11月间,在复旦大学眼耳鼻喉科医院就诊的4650名HMC和8850名核性ACR患者临床资料的对比分析发现:与ACR相比,HMC具有发病年龄小、核混浊程度重、黑核及玻璃体液化发生率高的临床特点(表1)。
表1 ARC和HMC患者临床特点比较
研究者收集了2016年1月至6月期间在本院行白内障手术的133名ARC和155名HMC患者的前囊膜,对晶状体上皮细胞(LECs)进行总抗氧化能力(T-AOC)及丙二醛(MDA,为脂质过氧化的指标)测定。结果显示,HMC组总抗氧化能力降低、MDA浓度增高,即氧化损伤加重(图1)。
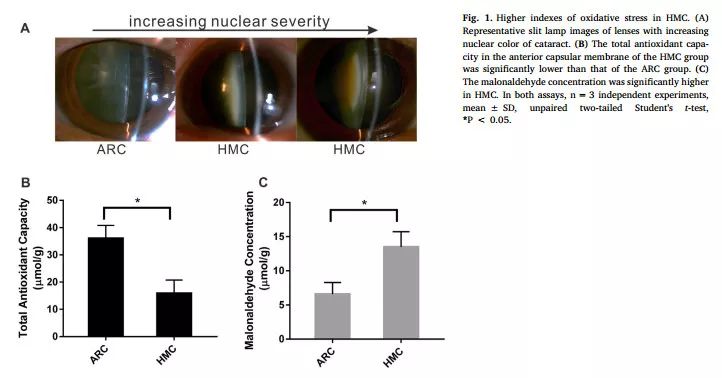
图1 HMC的氧化应激指标
HMC抗氧化基因GSTP1、TXNRD2表达下降、启动子甲基化增高
为找到HMC晶状体囊膜抗氧化能力下降的原因,研究者采用Sequenom MassARRAY技术,比较了HMC和ARC晶状体囊膜6种抗氧化基因GSTP1, TXNRD2, NRF2,OGG1, TXN和TXNRD1的甲基化水平和表达水平。发现HMC组GSTP1和TXNRD2启动子CpG单位的甲基化水平明显增高(图2)。
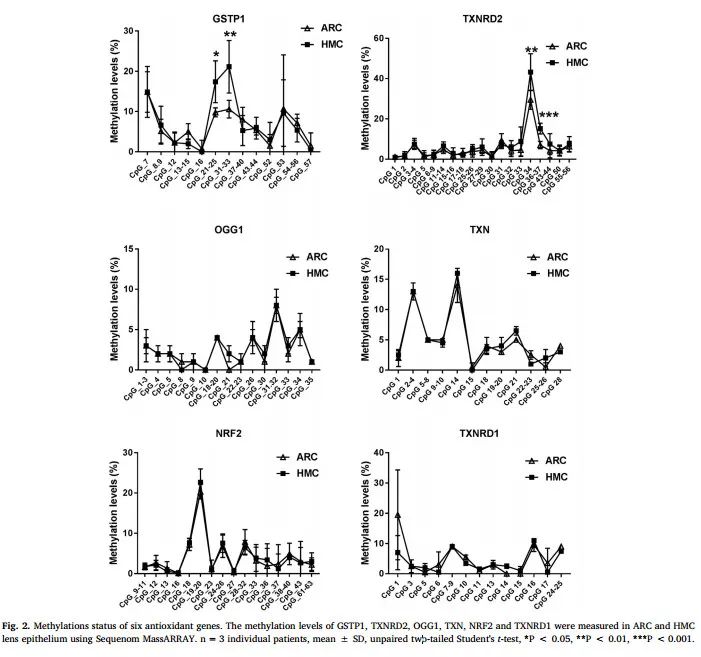
图2 6种抗氧化基因的甲基化水平
研究者进一步对上述两个的特定CpG区域,即GSTP1(#21–25)和TXNRD2(#34)进行甲基化水平重复测定,同时测定GSTP1、TXNRD2 mRNA和蛋白水平的表达量。结果显示,HMC组GSTP1(#21–25)和TXNRD2(#34)的甲基化水平升高有显著统计学意义,GSTP1、TXNRD2表达显著降低(图3)。
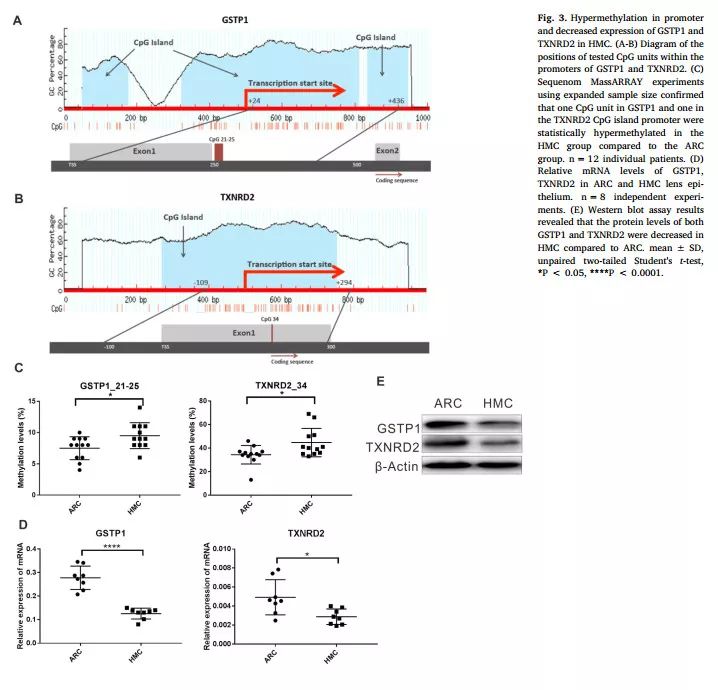
图3 GSTP1和TXNRD2的甲基化和表达水平
研究者为进一步证实GSTP1和TXNRD2蛋白在LECs的表达部位和表达水平,采用免疫荧光染色对两组样本进行半定量分析。结果显示,GSTP1和TXNRD2蛋白在晶状体囊膜附着的LECs胞浆中表达,且HMC组表达显著低于ARC组(图4)。
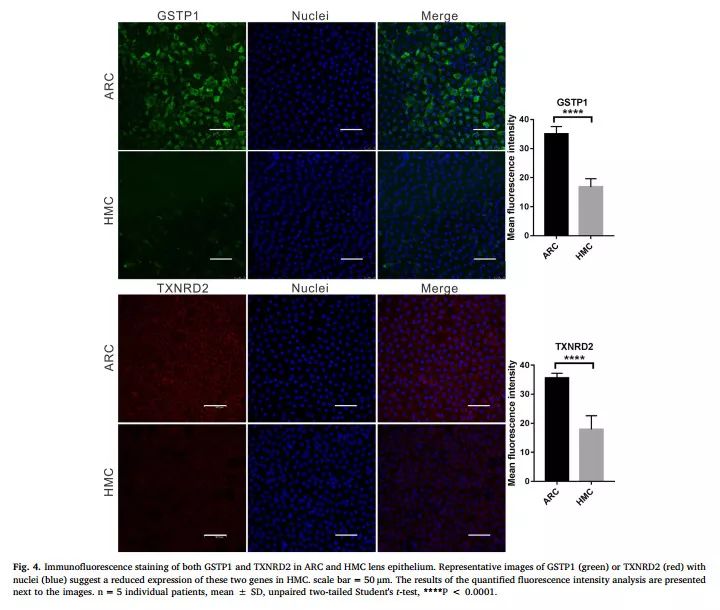
图4 GSTP1和TXNRD2在LECs中的免疫荧光染色
GSTP1、TXNRD2水平影响LECs的抗氧化能力
以上结果仅证实了GSTP1、TXNRD2在HMC中的表达变化,研究者为证实其对晶体抗氧化能力的影响,分别采用过表达质粒构建及siRNA使培养LECs过表达和低表达GSTP1、TXNRD2后,测定总抗氧化能力(T-AOC)的变化。结果显示,GSTP1、TXNRD2表达上调后,LECs的T-AOC升高,反之则下降(图5)。GSTP1表达变化后T-AOC变化更明显。说明GSTP1、TXNRD2对LECs的抗氧化能力起正向调节作用。
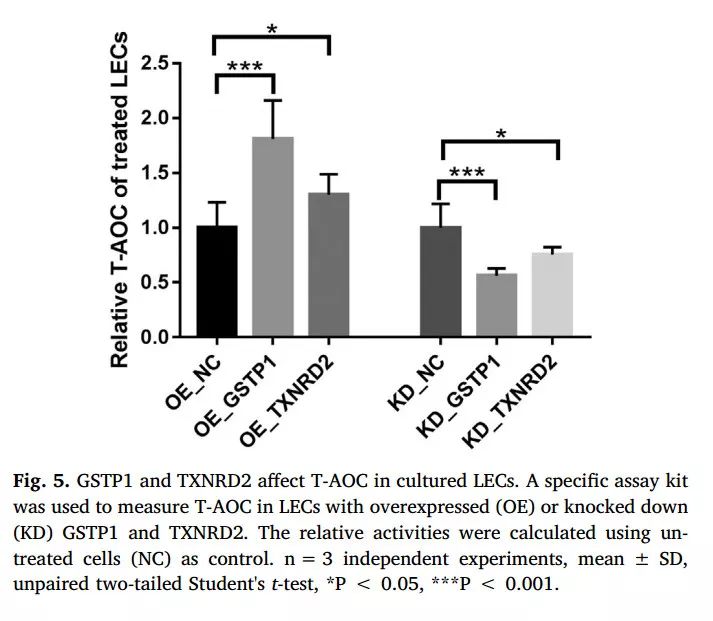
图5 GSTP1、TXNRD2对LECs抗氧化能力的影响
研究者采用荧光素酶报告实验,研究抗氧化基因启动子不同DNA片段甲基化对启动子活性的影响。结果显示,在去除GSTP1、TXNRD2启动子高甲基化DNA片段后,其转录活性显著降低(图6)。
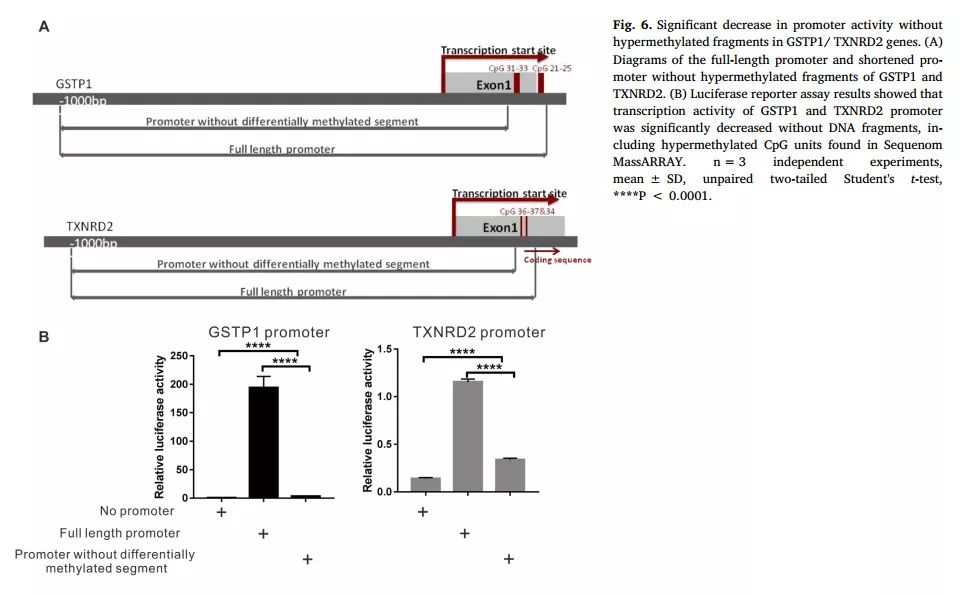
图6 GSTP1、TXNRD2启动子不同DNA片段甲基化对其活性
的影
响
研究者为明确HMC中GSTP1、TXNRD2启动子甲基化水平增高的原因,测定了HMC组样本中三种DNA甲基转移酶(DNA methyl transferase,DNMT)的活性。结果显示,DNMT1在HMC组表达增高,且在培养LECs中加入DNMT1抑制剂(5-Aza)抑制GSTP1、TXNRD2启动子甲基化后,GSTP1、TXNRD2表达水平上调(图7)。
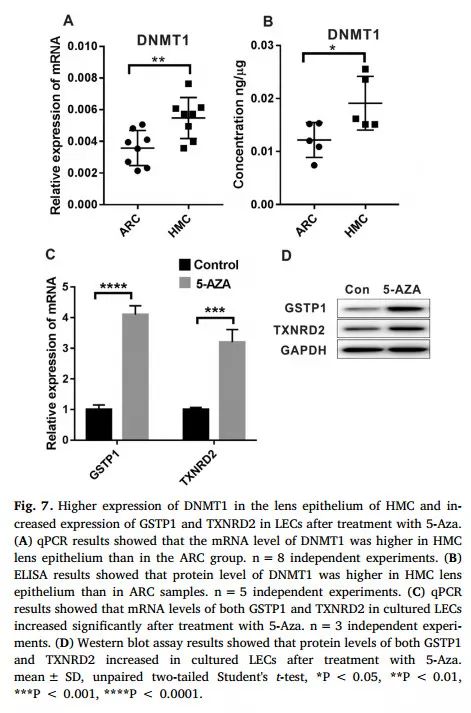
图7 DNMT1在HMC中的表达量及对GSTP1、TXNRD2的影响
高氧环境对GSTP1、TXNRD2启动子甲基化和表达的影响
上述结果证实了GSTP1、TXNRD2基因启动子甲基化及表达水平对LECs抗氧化能力的影响,但高氧环境究竟会不会影响GSTP1、TXNRD2的甲基化及表达呢?研究者采用H
2
O
2
模拟眼内的高氧环境,H
2
O
2
处理培养LECs0-8天后,结果显示GSTP1(#21–25)和TXNRD2(#34)甲基化水平呈时间依赖性增高(图8 D),而GSTP1和TXNRD2表达水平在0-6天内升高,在第8天时突然下降(图8 E)。这表明,在高氧环境下,GSTP1和TXNRD2的表达水平首先升高发挥抗氧化作用,随着其启动子甲基化程度增高,GSTP1和TXNRD2的表达下降,以致氧化损伤加重。
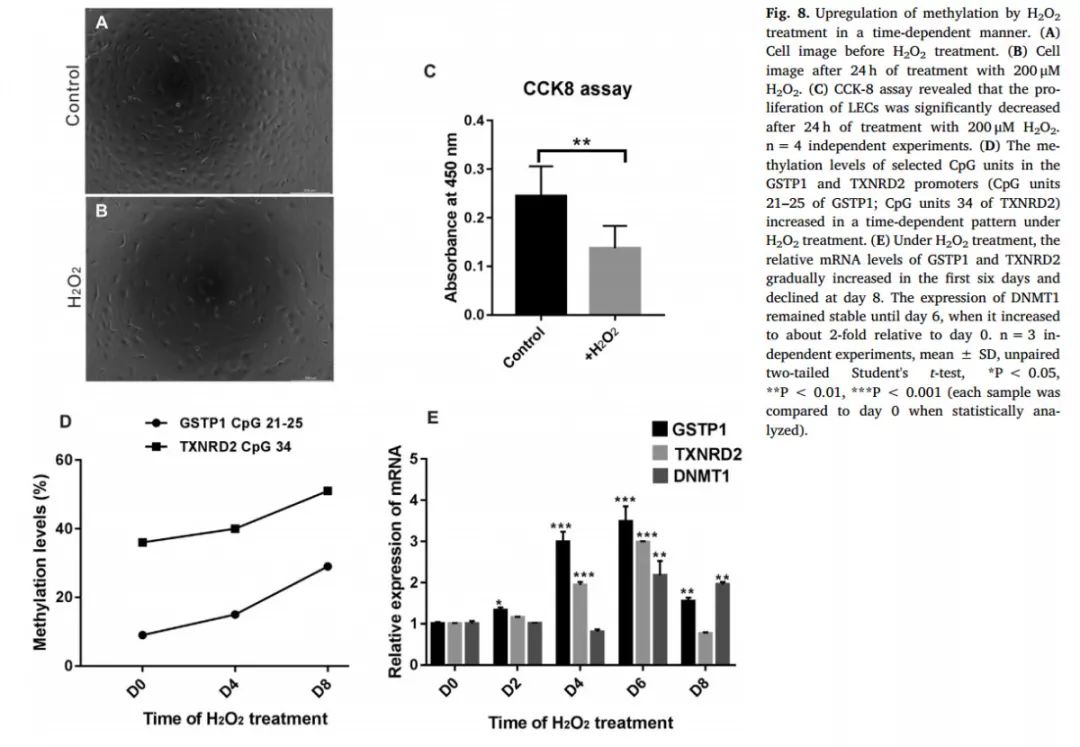
图8 高氧环境对GSTP1、TXNRD2启动子甲基化和表达的影响




