一支国际研究小组调查了4万个人类基因组数据,发现髓系先天免疫细胞突破前人想象地对AD发病有着重要作用。
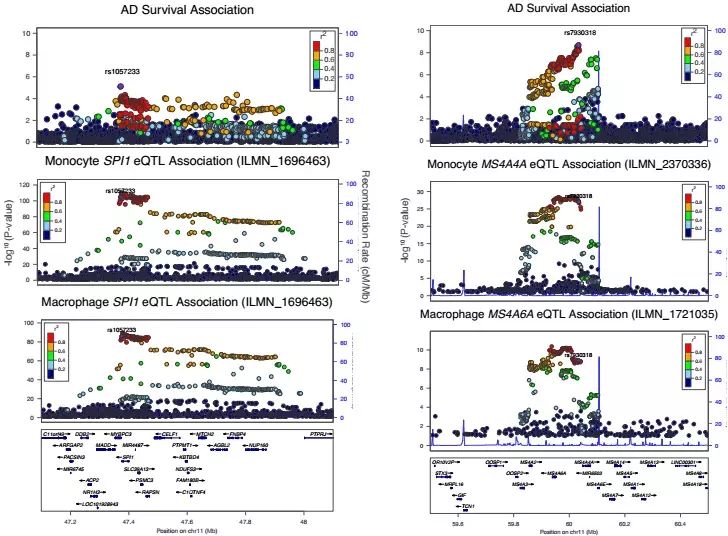
图一 AD患者基因组遗传与 eQTL 的精细定位
具体而言,研究小组鉴定了一个与AD有关的基因网络,发现髓细胞(包括巨噬细胞和小胶质细胞)能表达这些基因。
随后,研究人员鉴定了一个名为PU.1的转录因子,通过细胞和功能鉴定,发现它是这张基因网络的主使调控者。
研究人员利用遗传学方法分析了14406名AD患者和25849名非AD患者基因组,发现许多已知的与AD发病年龄有关的基因都在髓系细胞中表达。其中低水平的SPI1基因(编码转录因子PU.1)与AD发病年龄推迟有相关性。
为了验证这一假设,即SPI1表达水平影响AD风险基因和小胶质细胞功能,研究人员敲低了小鼠小胶质细胞系(BV2细胞)SPI1表达,发现细胞吞噬活性降低,过表达SPI1细胞吞噬能力增强。与此同时,许多其他AD基因表达也随SPI1表达操纵变化而变化。
“PU.1水平与小鼠胶质细胞吞噬活性和多种AD基因表达有相关性,”Goate博士说。“SPI1/PU.1表达可能是打破神经保护或神经毒性小胶质细胞功能平衡的罪魁祸首。”
这项研究表明,迟发性AD的遗传风险来自髓系细胞的表达基因,并非其他细胞。本文通讯作者、西奈山医学院神经科学教授Alison
Goate说:“该基因网络失调肯定是导致AD的原因,然而为了最终的治疗目标,我们仍需更深入地了解这一网络和PU.1的调节方式。”
研究人员强调,由于PU.1转录因子能调节多种基因,因此该蛋白质本身并非优选治疗靶点。相反,进一步研究PU.1在小胶质细胞和AD发病机制中的作用更为必要,相关研究可为有效调控AD发病的下游靶标的发现铺路。
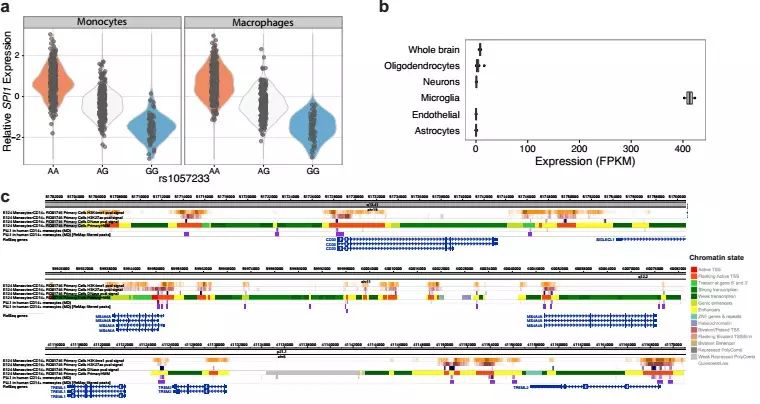
图二 SPI1(PU.1)表达和ChIP-Seq分析
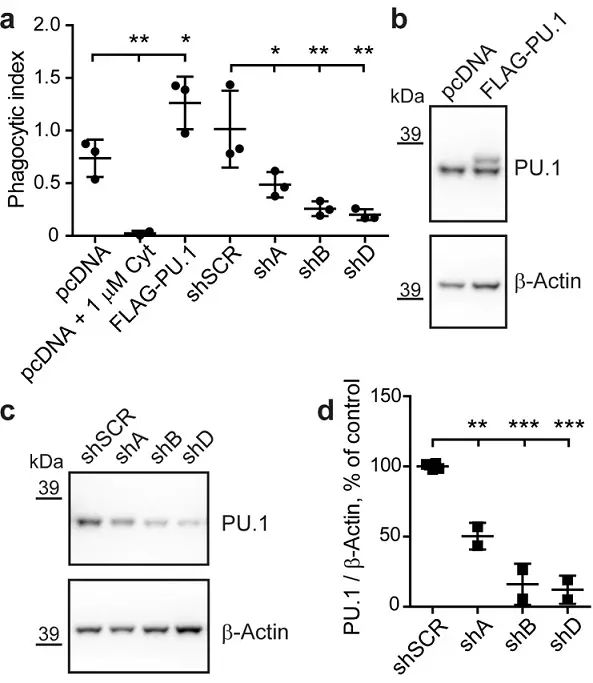
图三 PU.1调节BV2细胞吞噬活力
原文标题
A common haplotype lowers PU.1 expression in myeloid cells and delays onset of Alzheimer's disease






