 点击上方蓝字后,右上角设置 EngineeringForLife 为星标 ⭐,准时接收精彩内容推送~
点击上方蓝字后,右上角设置 EngineeringForLife 为星标 ⭐,准时接收精彩内容推送~

生命系统中生物配体的多价性不仅为生物机制的发现带来了灵感,也为模拟细胞外基质(ECM)的生物材料的设计带来了灵感。然而,设计可控的多价构建策略仍然具有挑战性。近日,来自江苏大学的潘国庆教授联合中国科学院深圳先进技术研究院王怀雨研究员(优青)、童丽萍副研究员通过将配体分子点击到明确的聚合物上,提出了一种精确的多价构建策略。作为概念验证,抗菌肽(AMP)被用作多价构建的模型配体,因为它能够增强抗菌活性并提高组织感染的治疗效率。此外,聚合AMP的带电分子结构可能通过多重静电相互作用促进动态生物医学水凝胶材料的形成。
相关研究成果以“Rational multivalency construction enables bactericidal effect amplification and dynamic biomaterial design”为题于2023年7月13日发表在《The Innovation》上。
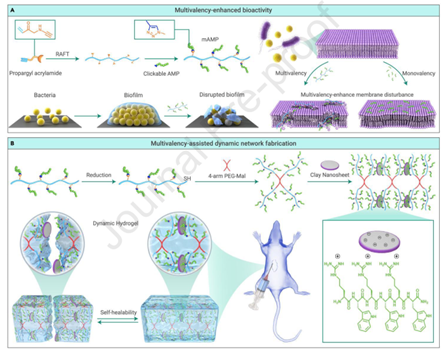
图1 mAMPs和动态水凝胶的制备和应用示意图
作者首先通过含炔基的炔丙基丙烯酰胺(PA)和亲水性2羟乙基丙烯酰胺(HEMA)的可逆加成断裂链转移(RAFT)聚合合成了一系列具有不同炔基侧基的明确线性聚合物。随后,用叠氮基封端的AMP单击含炔基的聚合物,形成精确控制的多价AMP (mAMP)(图1A,左)。mAMP的杀菌放大效应在体外和体内均得到证实(图1A,右)。此外,通过多重静电相互作用,最佳mAMP进一步用于动态水凝胶的设计(图1B,上)。由于其固有的抗菌活性,水凝胶可用于治疗感染的开放性皮肤伤口(图1B,下)。这种对伤口几何形状的高度适应性、对应力引起的碎裂的有效抵抗力和增强的杀菌效果可能有助于对受伤部位进行有效消毒并在皮肤伤口修复过程中提供持续支持。
1. 多价聚合物合成及其抗菌性能
作者首先合成了获得了三种聚合物:PHA-PPA3、PHA-PPA6和PHA-PPA10,其炔基重复单元数量不断增加,但链长相似(聚合度约为30)。根据核磁氢谱确定了聚合物的PA重复单元数和分子量凝胶渗透色谱(GPC)证实所有三种PHA-PPAn聚合物具有非常相似的分子量和低多分散指数(PDI,约1.09~1.17)(图2B),表明RAFT聚合对于制备多价炔基聚合物具有高度可控性。多价AMP聚合物也通过NMR进行了表征。与PHA-PPAn相比,mAMPn样品的1H NMR谱显示出特征AMP峰,证实了mAMPn的成功合成(图2C)。
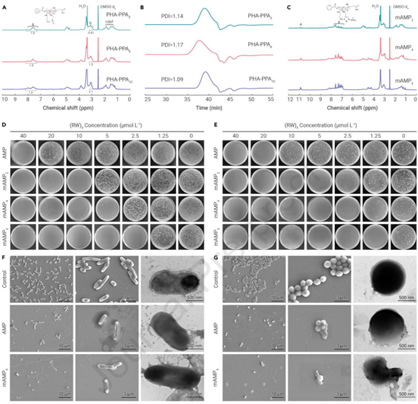
图2 mAMP的化学表征和抗菌活性
接着,作者评估了多价对AMP内在抗菌活性的影响(图2D)。mAMPn聚合物和游离AMP分子均表现出针对革兰氏阴性大肠杆菌的浓度依赖性抗菌活性(图2D)。mAMPn聚合物和游离AMP分子均表现出针对革兰氏阴性大肠杆菌的浓度依赖性抗菌活性(图2D)。在针对革兰氏阳性金黄色葡萄球菌的测试中观察到类似的结果(图2E)。
此外,作者还通过SEM和TEM检查了处理后细菌的膜形态(图2F-G)。SEM图像显示,处理后细菌数量显着减少,形态大多呈现塌陷和融合状态,表明细菌细胞壁被高效破坏。TEM图像进一步显示,对照组细菌上清晰可见的膜在AMP和mAMP6处理后消失,留下不完整的形态,仅留下微量渗漏的细胞质基质。因此,与单价AMP相比,mAMPn更强的静电结合力和配体限制可能导致膜分布局部增强,这对抗菌活性的放大有很大贡献。
2. 多价抗菌机制
作者推测mAMPn的杀菌放大效应是由于多价分子的配体结合局部增强(图3A)。为了验证这一假设,通过CLSM研究了AMP和mAMPn与细菌的结合。与异硫氰酸荧光素(FITC)标记的AMP和mAMPn共孵育,作者发现mAMP6处理的细菌上出现的FITC绿色荧光明显强于AMP处理的细菌(图3B)。定量分析表明,AMP和mAMP6聚合物的细菌结合率分别为22.9%和51.9%(图3C)。石英晶体微天平(QCM)测试证实了这一结果。溶液注射后频率(f)的显着降低更直观地证明了更强的结合作用,并证实了mAMP6聚合物在细菌膜上的多价增强配体结合(图3D-E)。因此,局部配体浓度和mAMPn在细菌膜上的结合力要高得多,可以显着增强对阴离子磷脂层的干扰,从而表现出放大的杀菌效果。

图3 mAMPn的增强抗菌机制
此外,在临床上,慢性伤口感染中的细菌生物膜极难治愈。因此,作者尝试应用多价抗菌聚合物来消除生物膜。如图3F所示,mAMP6处理8 h后,原本致密的生物膜明显减少,表面变得稀疏且不规则(图3G)。因此而初步推断,多价结合可以加速生物膜保护层(例如细胞外聚合物)的渗透和去除,从而暴露内部细菌。在失去屏障功能后,受损的生物膜很容易被渗透mAMP6聚合物,导致生物膜根除效率提高(图3H)。
3. 体内抗感染能力
然后,作者在大鼠中建立了金黄色葡萄球菌感染的皮肤伤口模型,以研究mAMPn的体内抗感染潜力(图4A)并评估抗感染和伤口愈合过程(图4B)。早期,PBS组和PH-PPA组感染创面可见明显的黄色脓液,表明感染的严重程度。但在AMP和mAMP6组中没有观察到这种化脓性感染,这也通过伤口部位组织渗出物的琼脂平板计数方法得到证实(图4C和4D)。除了更强的抗感染特性外,mAMP6处理的伤口在14天内表现出最快的伤口闭合率(图4E)。HE和Masson染色也进一步证实了这一点(图4F-G)。这些结果共同证明了mAMP6作为抗菌治疗剂治疗体内细菌感染和改善伤口愈合的前景。
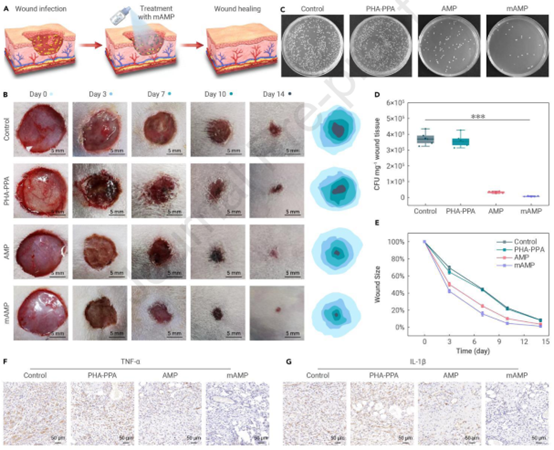
图4 mAMPn的体内抗菌活性
4. 动态水凝胶制造
接着,作者进一步使用多价mAMPn聚合物来制造具有动态结构的类ECM生物材料。通过硫醇还原和迈克尔加成反应,mAMP6聚合物成功连接到4-arm-PEG上(图5A)。由于具有多个胍基团,PEG-mAMP6聚合物可以通过多重静电相互作用与粘土纳米片(CNS)快速交联(图5B、5D)。水凝胶(mAMP-Gel)具有多孔结构(图5C),同时还表现出典型的动态特性,例如自愈能力、可重塑性和可注射性(图5E-G)。由于动态水凝胶在生物医学方面具有巨大的潜力,因此进一步研究了所得mAMP-Gel的一些关键参数(溶胀率、降解率、抗菌活性和生物相容性)(图5K-Q),结果表明这种动态mAMP-Gel水凝胶作为生物相容性和抗感染支架生物材料的巨大潜力,特别是用于治疗和修复易感染组织。
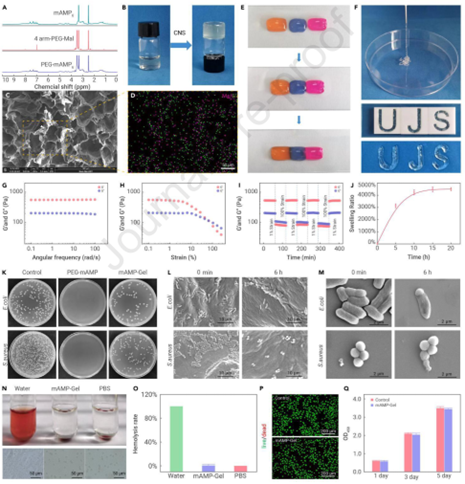
图5 mAMP-Gel的表征
5. 使用动态水凝胶作为伤口敷料
基于这种动态抗菌水凝胶,作者进一步在大鼠皮肤上建立了全层感染伤口模型,以研究水凝胶作为先进伤口敷料材料用于感染皮肤修复和再生的潜力(图6A)。由于细菌的快速消除,mAMP-Gel组的组织重建过程及时启动,该组的伤口在14天内愈合(图6B-D)。
作者进一步使用H&E和Masson染色来评估组织愈合效果(图6E-F)。mAMP-Gel组的皮肤缺损几乎闭合,上皮高度规则,毛囊众多,胶原有序沉积,真皮组织几乎完全再生;而对照组则不完整,创面周围沉积大面积未成熟肉芽组织。定量分析显示mAMP-Gel组的毛囊数量、肉芽长度和胶原沉积均显着改善(图6G-6I)。此外,由于mAMP-Gel的抗感染能力,TNF-α和IL-1β的表达水平也显着降低,这可以显着减轻炎症反应(图6J)。

图6 mAMP-Gel的体内抗菌活性
综上,本文报道了一种通过结合受控聚合和点击化学来构建多价的精确策略,然后应用生成的多价分子来制造动态水凝胶材料。首先通过RAFT聚合合成了一系列具有不同炔基侧基的明确线性聚合物,随后将炔基聚合物与叠氮基-AMP 点击以获得精确控制的多价AMP聚合物(mAMP)。由于阳离子AMP配体的聚集和对细菌膜的局部增强的干扰,mAMPs显着放大了杀菌效果(8~10倍)。作为一种类似ECM的动态生物材料,mAMP衍生的水凝胶表现出典型的动态特性,包括自愈能力、可注射性和可重塑性。此外,由于其固有的抗菌活性,这种水凝胶可用于治疗感染的开放性皮肤伤口。总之,这项工作提出的多价构建策略为组织修复和再生的高活性和动态生物材料的仿生设计提供了新思路。
文章来源:
https://doi.org/10.1016/j.xinn.2023.100483
入群交流
围绕再生医学研究方向,EFL公众号建有“学术交流群”,扫描下方二维码加小编微信即可入群交流~










