作者 l
放翁是水货
编辑
l
Childlikecat
Genentech以免疫疗法为基础的联合疗法显著延长小细胞肺癌患者的生存期
6月25日,美国,Genentech今日宣布3期临床IMpower133研究在肿瘤无进展生存期和总存活率方面的主要终点均已达到。这是一项多中心随机双盲安慰剂对照3期临床研究,旨在评估以TECENTRIQ为基础的联合疗法对于小细胞肺癌的有效性和安全性。研究表明,与单纯化疗相比,TECENTRIQ(atezolizumab)联合化疗(卡铂和依托泊苷)作为一线疗法治疗小细胞肺癌可以大幅度的延长患者的生存期,联合疗法也降低了疾病恶化或死亡的风险,同时联合疗法的安全性与已知的TECENTRIQ单药治疗安全性一致,没有发现新的安全事件。试验数据将以最快的速度提交给全球卫生当局,以期尽快批准该疗法用于小细胞肺癌患者的一线治疗。
小编点评:
在过去20年中,小细胞肺癌的治疗进展相当有限,该项研究是首次大规模的以免疫疗法为基础的联合疗法治疗小细胞肺癌的三期临床研究。Impower 133研究的临床结果为肺癌的治疗增加了越来越多的证据,同时其也证明以TECENTRIQ为基础的联合疗法可能是治疗不同类型晚期肺癌的有效方法。目前Genentech有8项3期肺癌研究正在进行评估。
Merrimack公布了MM-141作为一线治疗转移性胰腺癌2期临床研究最新进展
6月25日,美国,Merrimack Pharmaceuticals今日宣布CARRIE研究的最新结果,数据显示新的疗法并未获得有效性方面的主要和次要终点。基于这些结果,Merrimack不会将额外的资源投入到MM-141的开发上。这是一项全球、双盲、随机、安慰剂对照2期临床试验,着重评估在先前未治疗的转移性胰腺癌患者中,在标准护理治疗基础上添加MM-141(Istiretamab)治疗的有效性。研究的主要终点是无进展生存期,次要终点包括客观应答率、疾病控制率、应答持续时间、总体生存期和安全性。分析数据显示与单独使用Nab-紫杉醇和吉西他滨相比,联合疗法并没有带来更多的临床获益。

FDA受理了Merck关于KEYTRUDA作为辅助疗法治疗黑色素瘤的补充申请
6月26日,美国,Merck公司今日宣布美国食品和药物管理局已受理了该公司抗PD-1疗法KEYTRUDA作为高危3期黑色素瘤辅助治疗的补充生物制剂许可申请并按流程进行标准审查。该项补充申请是基于前期的一项关键3期临床研究,这项与欧洲癌症研究和治疗组织(EORTC)合作进行的关键3期EORTC1325/KEYNOTE-054研究中已经证明KEYTRUDA治疗能够让黑色素瘤患者获得更为显著生存获益。研究相关的详细数据已经在AACR-2018年会上公布,并在《新英格兰医学杂志》上发表。
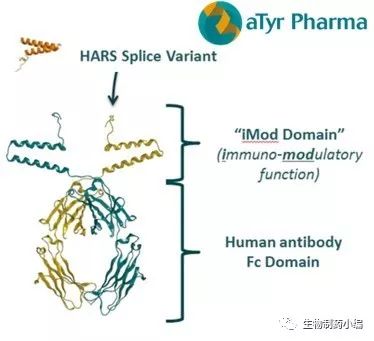
aTyr Pharma公布了其新药ATYR1923的1期临床试验结果
6月27日,美国,aTyr Pharma公司今日宣布其在研新药ATYR1923的1期临床取得满意的结果。ATYR1923是一种治疗性的免疫调节候选药物,在间质性肺病方面具有潜在且广泛的治疗应用。这项首次在人体内进行的随机双盲安慰剂对照研究,旨在探究ATYR1923在健康志愿者中的安全性、耐受性、免疫原性和药代动力学特性。结果表明,该药物在所有剂量水平下均表现出良好的耐受性,ATYR1923给药后一个月随访期间均未观察到明显的不良事件或抗药物抗体的产生。高剂量ATYR1923给药后在一个月随访期结束时能够持续维持高血清浓度,这一数据也支持了每月一次给药方案的可能性。按照临床计划公司将在今年第四季度开发和启动新的临床试验。
Infliximab生物类似药ABP 710的3期临床取得进展
6月27日,美国,Amgen今日公布了一项评估生物类似药ABP 710与英夫利昔单抗治疗中重度类风湿关节炎疗效和安全性的三期研究结果。该项研究系统性比较了两种药物在美国风湿病学会(ACR)标准(疾病改善的反应差异)等各项指标上的优劣,其中包括ACR50、ACR70和疾病活动性评分28 - 联合计数C反应蛋白(DAS28 - CRP)等指标。结果证实与英夫利昔单抗相比ABP 710表现出非劣效性,但基于其主要疗效终点的优势也并不明显,总体而言ABP 710和英夫利昔单抗的安全性和免疫原性相当。
小编点评:
Amgen的产品组合中共有10种生物仿制药,其中两种在美国获得批准,三种在欧盟获得批准,ABP 710的积极试验结果将进一步推动公司仿制药产品占据现有的市场份额。

基于新药ARGX-115的研究进展,Argenx再一次获得AbbVie的里程碑付款
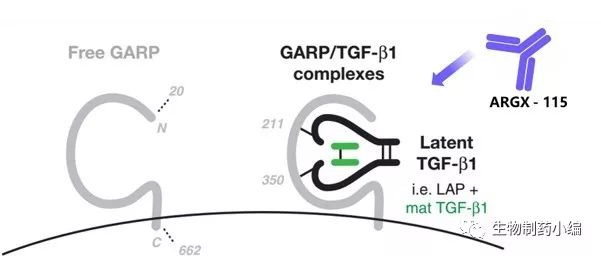
6月28日,荷兰/比利时,Argenx今天宣布基于ARGX- 115的新药研究申请,其已经获得了临床试验前的第二个里程碑付款,AbbVie进一步向公司支付了1000万美元。2016年4月,Argenx与AbbVie签订了开发和独家许可期权协议,以开发ARGX - 115并将其商业化。根据该协议的条款,Argenx有资格获得两个临床前里程碑付款,每次1000万美元。
ARGX- 115采用Argenx的SIMPLE Antibody(TM)抗体技术研发而成,可以特异性结合糖蛋白GARP,在调节TGF-β的产生和释放中发挥关键作用。ARGX – 115的前期数据证实其可以选择性地限制激活的调节性T细胞( Tregs )的免疫抑制活性,从而刺激免疫系统攻击癌细胞。
Alexion向欧盟递交了ALXN1210治疗阵发性睡眠性血红蛋白尿症( PNH )的许可申请
6月28日,美国,Alexion今天宣布向欧洲药物管理局提交了一份ALXN1210的市场授权申请,申请将该公司的长效C5补体抑制剂用于治疗阵发性睡眠性血红蛋白尿症( PNH )。继公司最近在美国提交申请后,ALXN1210在全球每一个地区的上市申请都得到公司的高度重视,公司的终极目标是将ALXN1210建立为新的PNH患者护理治疗的标准疗法。除了欧盟和美国的上市申请之外,Alexion还准备在下半年向日本卫生当局提交ALXN1210的新药申请。
Kymab联合罗氏共同开展临床研究探索晚期实体瘤的治疗
6月28日,英国,Kymab公司今日宣布与罗氏签订临床试验合作协议,根据协议罗氏将提供其PD-L1阻断抗体Atezolizumab,结合该公司的抗ICOS抗体KY1044,在晚期实体癌症患者中开展1/2期临床研究。Kymab将负责进行临床试验,两家公司将分享试验数据,同时Kymab继续保留KY1044的所有商业权利。
Arsanis终止了ASN100预防金葡菌感染(呼吸机相关肺炎)的2期临床研究
6月28日,美国/澳大利亚,Arsanis公司今日宣布经过独立数据审查委员会的中期分析后,其预防高危机械通气患者金黄色葡萄球菌肺炎的ASN100二期临床试验正式终止。根据这一分析结果,DRC确定试验是徒劳的,不可能达到主要终点,同时Arsanis计划根据研究方案对所有服用ASN100的患者进行随访,以进一步评估其影响。
BioAtla公司正式在晚期肿瘤患者中开展其新药BA3021的临床研究
6月28日,美国,BioAtla公司今日宣布其正在开展的BA3021-001临床研究已经有第一位患者正式入组接受治疗。BA3021是一种新型的条件性激活ROR2靶向抗体-药物偶联物(CAB-ROR2-ADC)。这项多中心开放标签1/2期研究旨在评估BA3021在晚期实体瘤患者中的安全性、耐受性、药动学、免疫原性和抗肿瘤活性,包括非小细胞肺癌、三阴性乳腺癌和软组织肉瘤。
礼来公布了Taltz(Ixekizumab)在TNF抑制剂经治的强直性脊柱炎患者中的第二个3期临床的积极结果
6月28日,美国,Eli Lilly今日宣布Taltz (Ixekizumab)治疗TNF抑制剂经治的强直性脊柱炎3期临床COAST– W研究达到主要和次要终点。这是一项评估Taltz治疗强直性脊柱炎(AS)的安全性和有效性的3期临床研究,这是首次针对经受过肿瘤坏死因子(TNF)抑制剂治疗的患者(90%的患者)或对TNF抑制剂不耐受(10 %)的难以治疗的患者群体进行的研究。试验数据显示与安慰剂相比,AS的症状和体征在统计学上有显著改善。
AS是影响骨盆关节和脊柱的一种脊椎关节炎,其特征是持续性的慢性炎性引起患者背痛、腰部僵硬以及活动能力受损。现有的积极结果再加上先前三期临床COAST-V研究的结果,为Taltz作为AS患者的潜在治疗选择提供进一步的支持。根据COAST - V和COAST - W研究的积极结果,该公司计划在今年晚些时候提交美国监管部门提交许可申请。
Cablivi(Caplacizumab)获得CHMP的积极推荐
6月29日,法国,欧洲药品管理局人类用药品委员会建议批准Caplacizumab用于治疗患有获得性血栓性血小板减少性紫癜( aTTP )的成年人,这是一种罕见的凝血障碍。欧盟委员会将审查CHMP的建议,预计未来几个月将对Cablivi(Caplacizumab)在欧盟的营销授权申请做出最终决定。Cablivi(Caplacizumab)是Ablynx公司第一个受到CHMP积极推荐的纳米抗体药物,如果获得批准,将是第一个专门用于治疗aTTP的治疗药物。

Celgene和Acceleron宣布中低风险骨髓增生异常综合征3期临床达到主要终点
6月29日,美国,Celgene和Acceleron今日宣布其正在开展的Luspatercept治疗中低风险骨髓增生异常综合征3期临床达到主要和次要终点。这项三期随机双盲多中心临床MEDALIST研究评估了Luspatercept与安慰剂相比对促红细胞生成素(ESA)治疗不耐受且需要频繁输注红细胞的低或中等风险骨髓增生异常综合征(MDS)的慢性贫血患者的疗效和安全性。结果显示,与安慰剂组相比,Luspatercept在最初24周内至少连续8周的红细胞(RBC)输注这一终点方面有统计学差异。除了达到研究的主要终点之外,Luspatercept还达到了关键的次要终点,即在头24周内,至少连续12周显示出RBC输血独立性的显著改善。研究中观察到的一般不良事件与先前公布的数据一致。
随着对β地中海贫血和骨髓纤维化等其他研究的深入,公司正在致力于探索运用Luspatercept解决一系列贫血相关疾病的潜力。
Opdivo (nivolumab)获得CHMP积极推荐用于黑色素瘤的辅助治疗
6月29日,美国,BMS公司今日宣布欧洲药品管理局人类用药委员会建议扩大对Opdivo (Nivolmab )目前适应症的批准,增加其用于已经完全切除的患有淋巴结转移或转移性黑色素瘤患者的辅助治疗,这是CHMP首次推荐PD-1抑制剂作为任何类型癌症的辅助治疗。CHMP的建议是基于3期CheckMate-238试验的数据,该试验对已经完全切除IIIB/C期或IV期黑色素瘤的患者进行Opdivo与Yervoy治疗研究,研究发现辅助治疗可以延长患者术后的肿瘤无进展生存期。
小编点评:
FDA此前已经扩大了对Opdivo的适应症范围,在2017年12月批准该药用于黑色素瘤患者的辅助治疗,CHMP这一积极的推荐进一步支持了Opdivo在辅助治疗中的潜力。
欢迎加入小编团队成为小编一员
请加小编微信号:wuwenjun7237
如有技术解读、行业洞见愿意分享
欢迎投稿到小编邮箱:
[email protected]














