这次文章的题目是
“
细胞极性蛋白Scrib——肝癌肿瘤抑制因子
”(回复
170517
可下载)

朕关注的公众号,出现了不少关于这篇文章的科普版简报。好奇咯,所以这期就深入地来看看这篇热文的实验与思路,别人看热闹,咱要看门道。Oncotarget影响因子5分,不算高。但作者单位,看着拽拽的~
Scrib是膜蛋白,涉及维持上皮组织顶端细胞极性,已知参与其他癌症。在哺乳动物中,细胞极性至少由3个蛋白质结构域(Scrib、Crumbs & Par)组成和维持。顶端(Crumbs & Par)和基底外侧(Scrib)的结构域互相拮抗以调节细胞的各种极化过程:如顶基极性、平面细胞极性、不对称细胞分裂和迁移等。当然还有参与其他过程,不赘述。
来,上图~
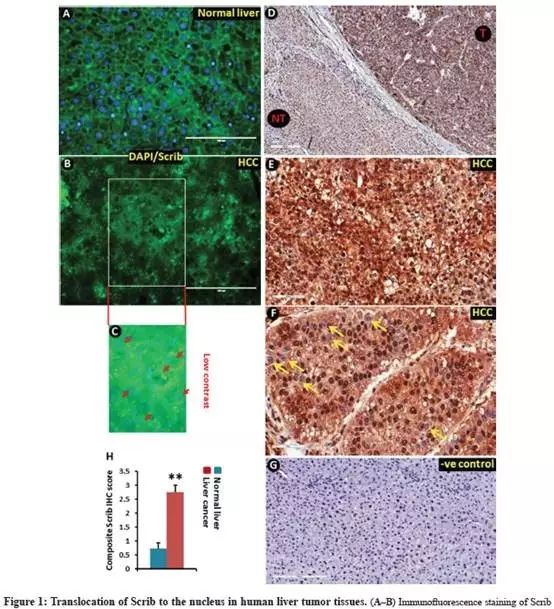
免疫荧光(IF)观察人肝癌样本中Scrib,发现结构良好,主要位于肝脏非肿瘤区域的细胞膜上(Fig.1A),蓝色为DAPI细胞核,绿色荧光为Scrib;
While,人类肝脏肿瘤细胞(HCC)样本中Scrib高度无组织性、没有明确定位(Fig.1B),Scrib被转移到细胞质中,似乎也存在于细胞核中;
绿色荧光非常强烈,DAPI相对弱,图像合并后几乎观察不到蓝色,红色箭头指向一些DAPI染色的细胞核(Fig.1C);
免疫组织化学法(IHC)进一步确定肝癌和非肿瘤肝脏之间的Scrib表达水平和定位,与非肿瘤区域(NT)相比,肿瘤区域(T)中检测到更多的Scrib染色(Fig.1D);
IHC染色还显示了人肝脏肿瘤组织细胞质和核腔中Scrib表达(Fig.1E-H);
临床样本后,进行动物实验。使用二乙基亚硝胺(DEN)诱导C57BL/6J野生型雄性小鼠中肝肿瘤,并进行Scrib的IF和IHC染色。
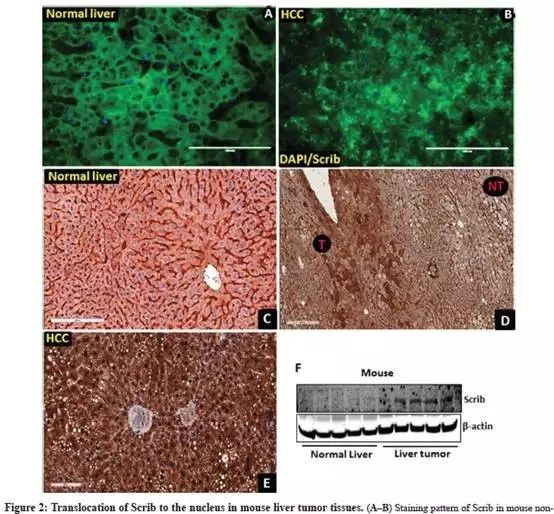
与人类样本类似,正常肝细胞中Scrib主要存在于膜上并且结构良好,而在肝脏肿瘤中Scrib定位在细胞质和细胞核中(Fig.2A-B);
IHC进一步证实,正常小鼠肝脏中,Scrib在细胞膜表达强烈(Fig.2C);与非肿瘤区域(NT)相比,肿瘤区域(T)中检测到更多更强的Scrib染色(Fig.2D);肿瘤细胞中,清楚地检测到Scrib扩散到细胞质和细胞核中(Fig.2E);
Western印迹检测,与非肿瘤组织相比,肝肿瘤中Scrib蛋白表达水平升高(Fig.2F)。
结果综合表明:Scrib在肝肿瘤中表达增加,并且当肝细胞癌变时,Scrib蛋白定位发生了改变,转移到细胞质&细胞核。
在活化增殖的肝癌细胞(HCC)中,Scrib定位在细胞核
在正常肝脏中,90%以上的细胞是静止的,Scrib定位在细胞膜(Fig.1A,2A,2C)。在肝肿瘤中,大部分细胞处于活跃的增殖状态,Scrib被转移到细胞质和细胞核(Fig.1E-F,2E)。
因此,作者猜想:当细胞处于主动增殖状态时,Scrib会发生定位改变,转移到细胞质和细胞核。
培养HCC细胞系(Hepa1-6,HepG2和Huh-7),通过IF和Western印迹进行验证。
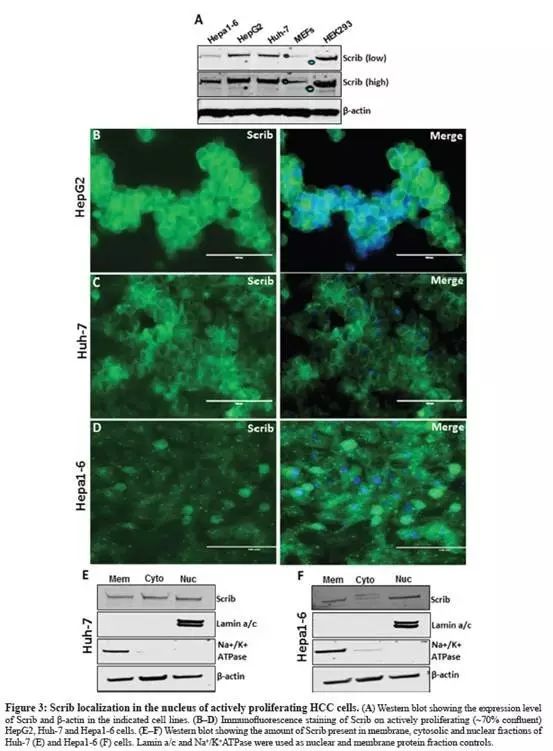
WB显示:HCC细胞系(Hepa1-6、HepG2、Huh-7)和肾上皮细胞系HEK293强烈表达Scrib,小鼠胚胎成纤维细胞(MEF)中Scrib表达相对较低(Fig.3A);
免疫荧光(IF)染色,在HepG2,Huh-7和Hepa1-6细胞中,Scrib存在于细胞质和细胞核中(Fig.3B-D);
从培养的Huh-7和Hepa1-6细胞提取细胞膜、细胞质和细胞核蛋白,在3组成分中都检测到了Scrib(Fig.3E-F),表明:在活跃的增殖细胞中,Scrib不仅转移到细胞质,而且也转移到细胞核。
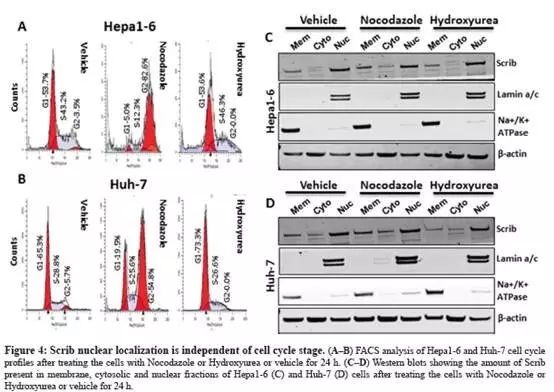
为了评估Scrib易位主要发生在细胞周期中的S期还是G2/M期,分别使用nocadazole和hydroxyurea阻断G2/M和G1/S周期(Fig.4A-B),流式细胞仪证明周期停滞;
使用nocadazole和hydroxyurea处理24小时后提蛋白做WB,Hepa1-6和Huh-7表现出一致结果,细胞核中的Scrib表达水平高于细胞质和膜(Fig.4C-D),表明Scrib的定位与特定的细胞周期无关。
接着,功能试验,超表达或者缺失~
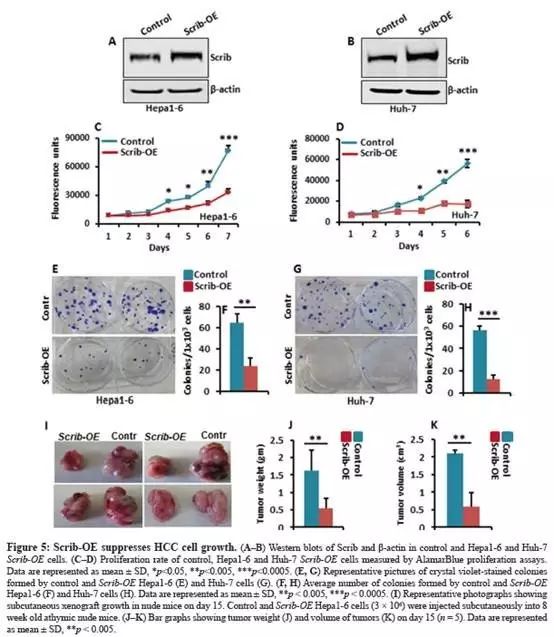
Scrib过表达(Scrib-OE)抑制HCC细胞体外生长,抑制异种移植瘤生长
Hepa1-6和Huh-7中过表达Scrib(Fig.5A-B);
Scrib过表达后,细胞增殖显著减少(Fig.5C-D);
集落形成试验,表明Scrib过表达会损害集落形成(Fig.5E-H);
表明Scrib的表达增加具有抑制HCC细胞生长对的作用。
为了进一步确定Scrib-OE对HCC细胞生长的影响,对无胸腺裸鼠进行皮下异种移植。
Scrib超表达组,异种移植肿瘤生长显著降低(Fig.5I-K);
这些结果表明:当Scrib表达增加时,具有生长抑制作用;Scrib在HCC细胞中起着抑制肿瘤作用。
超表达完,就是缺失/敲除。。。。。
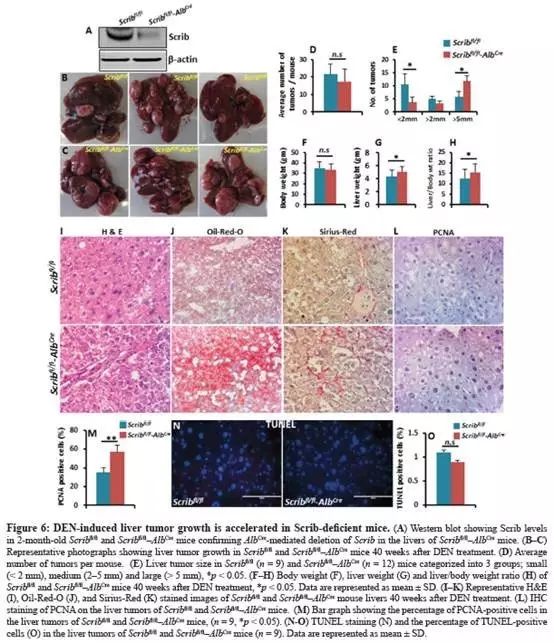
肝脏特异性Scrib缺陷型小鼠经DEN诱导,肝肿瘤发生增强
小鼠模型,特异性地删除Scrib(Fig.6A);小鼠敲除Scrib后没有任何自发性的发育不良、结节、肝肿瘤。(可做模型用)
DEN化学诱导肝癌模型,分析显示小鼠之间肝脏肿瘤的平均数没有显着变化(Fig.6B-D);
然而,进一步分析显示与对照小鼠相比,
Scrib
fl/fl
-
Alb
Cre
小鼠的较小肿瘤(<2mm)数量减少,较大肿瘤数量增加(> 5 mm)(Fig.6E),表明肝肿瘤生长在没有Scrib的情况下显着增加。
与肝肿瘤生长增加一致,肝脏重量和肝脏/体重比例也在
Scrib
fl/fl
-
Alb
Cre
小鼠中显著增加(Fig.6F-H);
组织学分析:与正常
Scrib
fl/fl
对比,
Scrib
fl/fl
-
Alb
Cre
(Scrib敲除)组显示肝脏肿瘤细胞增大核染色加深、生长紧凑(Fig.6I);脂肪堆积增加(Fig.6J);纤维化增加(Fig.6K);
PCNA染色显示,
Scrib
fl/fl
-
Alb
Cre
肝脏肿瘤增殖(Fig.6L-M),但没有检测到对凋亡影响(Fig.6N-O);
表明
Scrib
fl/fl
-
Alb
Cre
小鼠肿瘤生长增加是由于增殖而不是细胞凋亡引起的。这些结果表明,Scrib缺乏加速了肝肿瘤的生长,因此Scrib作为肝癌中的肿瘤抑制因子起作用。
深入分子机制
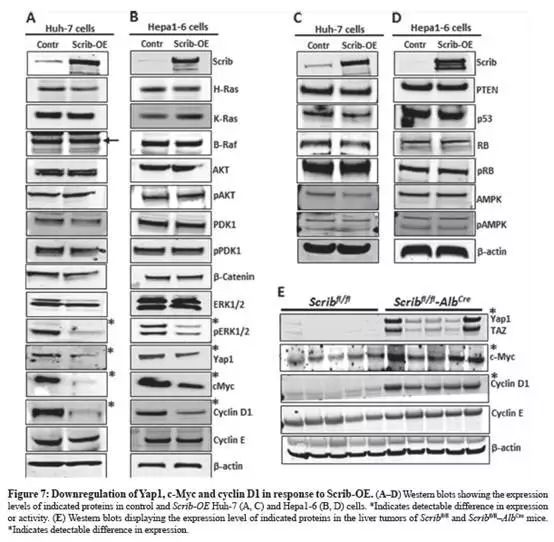
Scrib-OE使ERK激活受损、下调Yap1、c-Myc和 cyclinD1
转染Scrib -OE的Huh-7和Hepa1-6细胞中,ERK活化受损,Yap1、c-Myc和cyclinD1下调(Fig.7A-B,☀为下调);
然而,其他癌基因和肿瘤抑制因子的表达或者活性状态没有显著改变(Fig.7A-D);
那就挑有变化的往下做咯~
敲除Scrib的情况下这些基因是什么情况?
收集对照小鼠和模型小鼠肝脏肿瘤,跑Western:与正常Scribfl/fl肝肿瘤组织对比,Scribfl/fl- AlbCre(Scrib敲除)组增强YAP1、c-Myc和cyclinD1的表达(Fig.7E)。
The data show:Scrib通过抑制ERK的激活和下调Yap1、c-Myc和cyclinD1来抑制HCC细胞增殖和肝肿瘤生长。
通路~
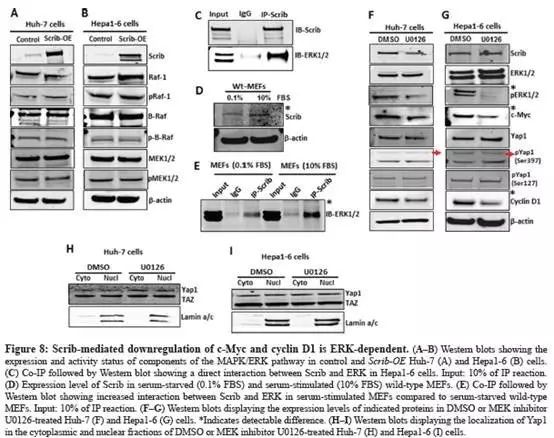
作者首先想是不是通过MAPK通路,调节ERK活性,然鹅,对照和Scrib-OE细胞在Raf1、b-Raf、MEK1/2的表达上没有任何显著差异(Fig.8A-B),说明新司机Scrib没开老路,这就更加值得去研究走了哪条新路。
看看新司机Scrib是否直接撩ERK,并抑制其磷酸化:免疫共沉淀(Co-IP)检测到Hepa1-6细胞中ERK和Scrib之间存在直接相互作用(Fig.8C);
在0.1%血清饥饿和10%血清刺激的野生型MEFs(小鼠胚胎成纤维细胞)细胞中分别进行Scrib/ERK Co-IP。10%血清刺激下Scrib表达增加(Fig.8D);
与0.1%血清饥饿条件相比,10%血清刺激后Scrib和ERK之间的相互作用显著增加(Fig.8E);
使用MEF代替HCC细胞进行血清饥饿和刺激实验,因为癌细胞是相对独立的有丝分裂原,不会因为血清饥饿而保持静止状态。
研究结果表明:有丝分裂途径激活ERK,Scrib通过直接结合ERK来控制ERK的磷酸化。
下面要验证是否通过ERK下调Yap1、cMyc和cyclinD1。
因此,使用MEK抑制剂U0126处理Hepa1-6和Huh-7细胞,检测到降低了ERK的活化,下调了c-Myc和cyclinD1(Fig.8F-G);
然而,Yap1表达、磷酸化、核定位均不受ERK抑制的影响(Fig.8F-I)。
表明:ERK在Scrib下游起作用,并调节c-Myc和cyclinD1;而Scrib介导的Yap1抑制不是通过ERK途径。
寻找调节Yap1的途径
找了个已知调节Yap1的途径——Hippo pathway,来检测是否走的这条道儿。需要通路中的核心蛋白MST、LATS、MOB1、SAV1等。
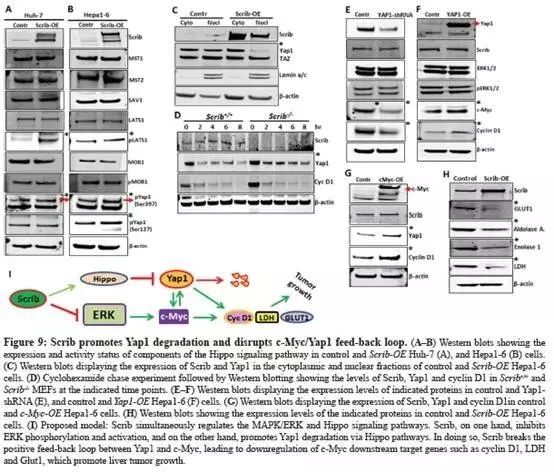
Scrib-OE组中,检测到LATS1(S909)的激活态磷酸化增加,并且增加了Yap1的磷酸化,从而引起Yap1随后的降解(Fig.9A-B);
与这结果相一致的是,Scrib-OE细胞中的核Yap1 减少;Hippo pathway途径中的另一种核转录因子TAZ不受影响(Fig.9C);
表明:Scrib主要控制HCC细胞中Yap1的磷酸化和降解。
通过放线菌酮追踪蛋白稳定性测定法(cycloheximide chase protein stability assay,没做过没见过,朕下去也要再查查),检测Scrib+/+和Scrib-/-MEFs中Yap1蛋白稳定性。Scrib-/-细胞中Yap1稳定性增加,cyclin D1的稳定性不变(Fig.9D);
结果综合表明:Scrib通过调节LATS1磷酸化来控制Yap1的稳定性。
Scrib通过ERK和Hippo信号通路抑制Yap1,c-Myc和cyclinD1抑制HCC细胞增殖和肝肿瘤生长。由于Scrib调节了两个单独的途径,这两个途径之间是否存在串扰?
用shRNA敲除YAP1,导致HCC细胞中c-Myc和cyclinD1下调(Fig.9E);
过表达YAP1后, HCC细胞中c-Myc和cyclinD1的表达增加(Fig.9F);
表明Yap1调节HCC细胞中c-Myc和cyclinD1的表达。
在HCC细胞中过表达c-Myc,检测到Yap1和cyclinD1的表达增加(Fig.9G);
说明Yap1和c-Myc之间存在正反馈回路。
为了进一步研究c-Myc是否是Scrib的最终下游靶点,对一些已知的c-Myc靶基因如Glut1、Enolase1、LDH的表达水平进行检测,在Scrib-OE细胞中明显下调(Fig.9H);
结果表明:MAPK/ERK和Hippo/Yap1途径之间存在串扰;Scrib抑制ERK,促进Yap1降解。
整个文章的故事路线见(Fig.I)。
英文科普版《Scrib protein identified as a natural suppressor of liver cancer》。Oncotarget的文章先前浏览过,也批讲过一期。这篇文章阅读整理时间远超预期,被傻白甜狠狠地撞了一下腰,555~。
尽管IF只有5分,但个人觉得无论意义、实验量,还是实验方法,这篇文章应当算得上白富美级别了:
一、意义:在精准医疗的环境要求下,Scrib能否作为靶点?能否作为前期基因分子诊断的标志物?
二、实验维度:①人样本,②实验动物,③细胞系,④分子机制,完美。试验周期不短,实验量不小,实验严谨。
三、信号通路:确定参与过程的途径就有两条,验证的还有几条。并且两条通路间还存在串扰。






