
“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度,解读一周数据,提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为超过100个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。

4月21日,国内领先的专注于脑深部电刺激系统研发与生产的医疗器械科技企业景昱医疗宣布完成逾亿元D轮融资。本次融资由燕创资本领投,德屹资本、太浩资本、上海业浩等机构跟投,华兴资本担任本次交易的独家财务顾问。
景昱医疗是一家集研发、生产、销售于一体的创新型高科技医疗器械企业。依据市场变化,公司不断进行技术革新和产品研发,已经累计获得了200余项国内专利和10余项国际专利。在神经科学前沿领域,景昱医疗凭借核心技术优势与自主研发能力已经取得了卓越成果,未来也将继续以领先技术深度赋能行业变革
。

4月22日,病原微生物检测明星企业金匙医学宣布牵手CPE源峰,完成C+轮融资。这是金匙医学继2020年11月完成2.3亿元C轮融资后,半年内再次完成数亿元级别的融资,持续引入战略投资者。
金匙医学作为感染病原基因检测行业领军企业,是业内唯一发布了基于二代测序和三代测序病原微生物高通量检测产品的企业,也是行业内唯一实现进口和国产测序平台双双高分通过国家临检中心mNGS室间质评的企业
。

4月20日,泰邦生物集团正式完成私有化交易,自即日起启动从纳斯达克主板退市程序。此次交易由大钲资本、中信资本、高瓴资本、淡马锡等知名投资机构组成的财团以14.8亿美元收购公司31%的股权,总估值约为47.6亿美元。
泰邦生物集团公司是中国领先的综合性血液制品和生物医药企业,核心业务包括血液制品和生物制品的研发、生产和销售。集团拥有亚洲规模最大的血液制品生产基地;拥有行业领先的研发团队和先进的血液制品研发实验室;拥有涵盖白蛋白、免疫球蛋白和凝血因子三大类、20多个品规的血液制品的产品线
。

4月19日,在完成6,500万美元的D轮融资后仅4个月,Virta Health又完成了总额为1.33亿美元的E轮融资,本次交易由Tiger Global牵头,公司估值为20亿美元,是D轮融资的两倍。
Virta Health是第一家致力于无需药物或手术即可逆转2型糖尿病的公司,提供了无需药物或手术即可安全、可持续地逆转2型糖尿病的首个治疗方法。在一年期临床试验中招募的患者中,有60%的人实现了糖尿病逆转,而94%的胰岛素使用者完全减少或取消了使用。结果不仅从糖尿病逆转到代谢和心血管健康的其他领域,还使血压,炎症,肝功能和BMI持续改善
。
新冠DNA疫苗首个全球多中心III期临床研究计划启动
4月24日,美国Inovio制药宣布将联合新冠DNA疫苗的合作伙伴苏州艾棣维欣生物制药,以及国际疫苗研究院等机构共同开展该III期临床研究。III期临床研究的目标是解决全球对于安全有效新冠疫苗的未满足需求。
信息来源:医药魔方
第二批高耗国采方案流出,百亿市场生变
4月19日,国家医保价采中心关于委托开展《国家组织人工关节类医用耗材集中带量采购方案(征求意见稿)》征求意见的函流出。本次集中带量采购标的为初次置换人工全髋关节、初次置换人工全膝关节两类医用耗材。2020年初次全髋、初次全膝关节置换术合计超过100例的公立医疗机构、军队医疗机构均应参加。其他公立医疗机构、军队医疗机构及医保定点社会办医疗机构按所在省份安排自愿参加。已自行开展人工关节类医用耗材集中带量采购,且尚在合同期内的省份,可顺延执行本次集采结果。采购周期为2年。
信息来源:医疗器械创新网

1.
PI3K双重抑制剂,石药集团引进的抗癌新药在中国申报上市
2.复宏汉霖PD-1单抗斯鲁利单抗上市注册申请获NMPA受理
3.FDA加速批准全球首款CD19-ADC药物上市,瓴路药业拥有中国权益
4.沛嘉获得国产TAVI第4张证
5.AI辅助心脑血管疾病检测,睿心医疗拿下首张NMPA三类证
6.FDA批准多款医疗器械产品上市

PI3K双重抑制剂,石药集团引进的抗癌新药在中国申报上市
4月19日,石药集团公告,其附属公司中奇制药的度恩西布胶囊上市申请已获得中国国家药品监督管理局受理,并获附条件批准上市及优先审评资格。根据公告,度恩西布胶囊按照化药5.1类申报,用于治疗既往至少经过两线治疗的复发/难治性滤泡性淋巴瘤成年患者。
信息来源:医药观澜
复宏汉霖PD-1单抗斯鲁利单抗上市注册申请获NMPA受理
4月22日,复宏汉霖宣布,自主研制的创新型PD-1抑制剂斯鲁利单抗注射液针对经标准治疗失败的、不可切除或转移性高度微卫星不稳定型实体瘤适应症的上市注册申请正式获得国家药品监督管理局受理,并拟纳入优先审评程序,有望成为国内首个治疗MSI-H实体瘤的抗PD-1单抗。
信息来源:佰傲谷
FDA加速批准全球首款CD19-ADC药物上市,瓴路药业拥有中国权益
4月24日,FDA已经加速批准ADC Therapeutics公司靶向CD19-ADC药物Loncastuximab tesirine上市,用以治疗复发性或难治性弥漫性大B细胞淋巴瘤。该产品是全球首款批准上市的CD19-ADC药物。
信息来源:佰傲谷
沛嘉获得国产TAVI第4张证
4月19日,沛嘉的TaurusOne®经导管主动脉瓣系统正式获得国家药品监督管理局批准上市。这是继启明、杰成、心通之后国产TAVI的第4张证,据悉还有更多类似产品正在拿证。可预见,连同欧美大牌爱德华在内,中国瓣膜市场将形成一家外企、多家民企同台竞技的热闹场面。
信息来源:医疗器械创新网
AI辅助心脑血管疾病检测,睿心医疗拿下首张NMPA三类证
4月16日,经国家药品监督管理局审查,睿心医疗的创新产品“冠状动脉CT血流储备分数计算软件”注册申请获批。由此,在各家AI三类证陆续获批随即启动商业化的当下,睿心智能也紧随其后,因睿心分数获批NMPA三类证迎来了新征程。
信息来源:亿欧
FDA批准多款医疗器械产品上市
4月14日,Acutus Medical 穿间隔套装获FDA批准;4月22日,美敦力第三代Pipeline Shield获FDA批准;4月24日,FDA批准Neurolutions的脑机接口产品IpsiHand上市。
信息来源:公开信息整理
1.
三代ALK抑制剂劳拉替尼在国内报产,四代也已在路上
2.创胜集团宣布其抗 PD-L1 和 TGF-β 双功能抗体新药 TST005 获得美国 FDA 许可开展临床试验
3.华领医药糖尿病首创新药多扎格列艾汀NDA获NMPA受理

三代ALK抑制剂劳拉替尼在国内报产,四代也已在路上
4月15日,辉瑞第三代ALK抑制剂Lorlatinib片的上市申请获批CDE受理。Lorlatinib是辉瑞研发的第三代间变性淋巴瘤激酶抑制剂,已于2018年12月被FDA批准用于治疗接受克唑替尼和至少一种其它ALK抑制剂治疗之后疾病发生恶化,或接受阿来替尼或色瑞替尼作为第一个ALK抑制剂治疗但疾病恶化的ALK阳性NSCLC。2021年3月,该药又被FDA批准用于一线治疗ALK阳性NSCLC。
创胜集团宣布其抗 PD-L1 和 TGF-β 双功能抗体新药 TST005 获得美国 FDA 许可开展临床试验
4月21日,宣布其抗 PD-L1 和 TGF-β 双功能抗体新药已获得美国食品药品监督管理局的许可开展临床试验。TST005 为一种双功能抗体,同时靶向两个通常被癌细胞用于逃逸免疫抑制的通路,即TGF-β及PD-L1。
华领医药糖尿病首创新药多扎格列艾汀NDA获NMPA受理
4月23日,华领医药宣布,糖尿病首创新药多扎格列艾汀递交的NDA申请已获国家药品监督管理局新药审评中心受理。多扎格列艾汀成为全球范围内首个提交新药上市申请的葡萄糖激酶激活剂类糖尿病治疗药物,并有望成为在中国首先上市的全球首创新药。
1.
由葛均波院士操刀,美敦力RND射频消融导管海南完成首例临床
2.博拓生物4月28日首发上会
3.IVD微球原料企业纳微科技IPO提交注册成功,即将登录科创板

由葛均波院士操刀,美敦力RND射频消融导管海南完成首例临床
4月16日,博鳌超级医院在国内首次应用Symplicity SpyralTM导管系统,顺利完成肾动脉交感神经射频消融术的临床应用,由此实现了我国高血压治疗从“单纯药物治疗”到“微创介入治疗”的医学科技提升,为数以亿计的高血压患者带来了长期、稳定控制血压的新希望。
4月23日,上海证券交易所科创板上市委员会定于4月28日召开上市委员会审议会议,届时将审议杭州博拓生物科技股份有限公司首发事项。博拓生物专注于POCT领域,主要从事POCT诊断试剂的研发、生产和销售。
IVD微球原料企业纳微科技IPO提交注册成功,即将登录科创板
4月21日,证监会发布消息,同意苏州纳微科技股份有限公司科创板首次公开发行股票注册。IVD上市企业即将再添一员。纳微科技是一家专门从事高性能纳米微球材料研发、规模化生产、销售及应用服务,为生物医药、分析检测及体外诊断等领域客户提供核心微球材料及相关技术解决方案的高新技术企业。
○
医疗与生命科技资本市场本周动态一览:
近期交易概况
(2021年04月19日-04月23
日)

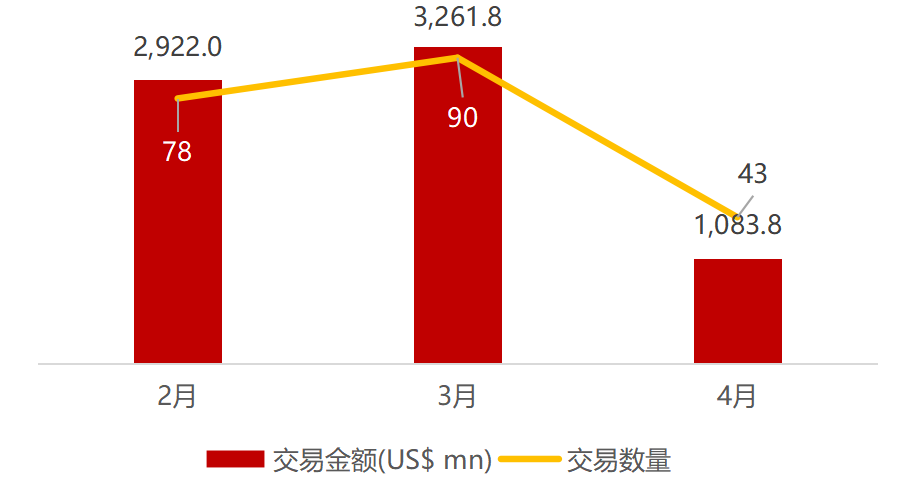
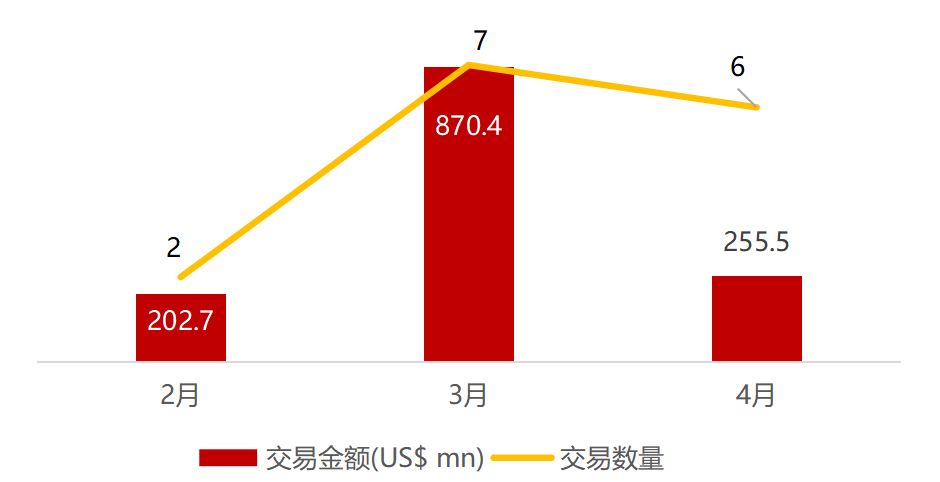
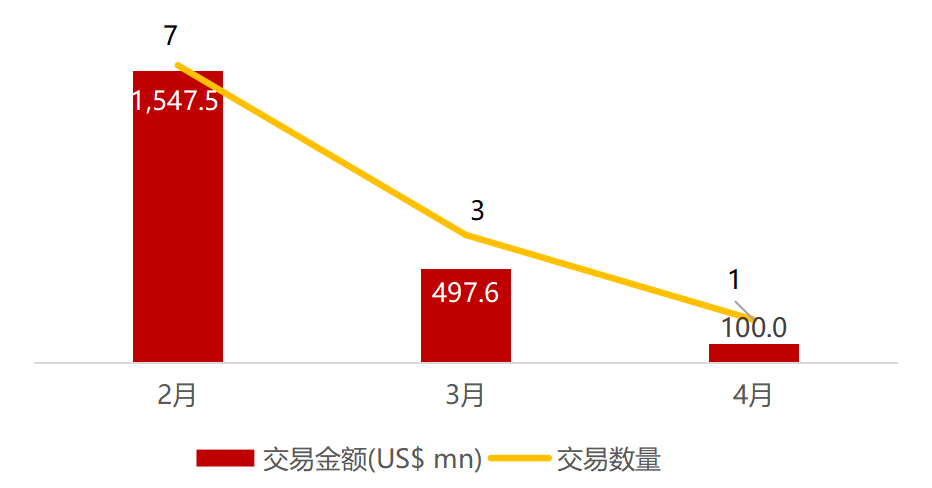
注:
境外二级市场指港股及美股


*数
据来源:
华兴资本内部整理
上市公司市值及估值倍数一览
(2021年04月23日)市值单位:百万美元

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >

< < 左右滑动图片查看完整表格 > >















