HPC-RA 荣誉出品
—— 文 字 稿 ——
简述FDA使用者付费
大家好,欢迎来到HPC药闻药事-RA频道。
今天,我们一起来了解FDA运作的一个重要动力来源-使用者付费(User Fee)。
FDA监管体系的完善和评审效率的提高,与使用者付费是紧密相连的。使用者付费的产生,不只来源于FDA自身,同样也包括消费者与医药行业。在过去的一段时间里,药品和生物制剂在FDA的评审进度不断延迟甚至无法预测,导致药品或生物制品的上市所需时间不断地增长。在二十世纪八十年代,FDA从接收申报到给出决定的平均所花时间为29个月。初步估算,每1个月的延迟会给申报企业增加1千万美元的经济成本。当时,国会不同意授权给FDA收取费用的权力,FDA因资金不足造成评审积压和进度缓慢。行业企业也认为这些费用可能会被用于降低联邦债务,而不能改善评审效率。

直到1992年,FDA与行业终于达成一致,从而促进了《处方药使用者付费法案》(Prescription Drug User Fee Act, PDUFA)的生效。时至今日,多个付费法案相继出台并不断地更新和完善,涵盖范围包括处方药、仿制药、生物制品、生物仿制药、医疗器械、动物用药、动物用仿制药、烟草制品等。而为了避免支付错误,使用者在支付时必须创建一个封面页(cover sheet)。封面页会要求提供一些信息以判断该使用者付费是否是需要的。申请人可以通过FDA网站访问封面页,设置账户和密码,在登录账户后进行相关操作,例如创建封面页、付费、查看账户状态等。
表1:FDA收费法案一览
|
法案
|
适用范围
|
|
Animal Drug User Fee Act (ADUFA)
|
动物处方药
|
|
Animal Generic Drug User Fee Act (AGDUFA)
|
动物仿制药
|
|
Biosimilar User Fee Act (BsUFA)
|
生物类似物
|
|
Color Additive Certification Fees
|
色素添加剂
|
|
Export Certificate Fees
|
出口认证
|
|
Food Safety Modernization Act (FSMA)
|
食品
|
|
Freedom of Information Act Fees (FOIA)
|
饲料
|
|
Generic Drug User Fee Amendments
|
仿制药
|
|
Human Drug Compounding Outsourcing Facility Fees
|
包材
|
|
Mammography Facility Fees (MQSA)
|
乳腺X线摄影
|
|
Medical Device User Fee Amendments (MDUFA)
|
医疗器械
|
|
Potential Over-the-Counter Monograph User Fees
|
OTC
|
|
Prescription Drug User Fee Act (PDUFA)
|
处方药
|
|
Family Smoking Prevention and Tobacco Control Act
|
烟草
|
|
...........
|
....
|
本期中将着重介绍一下大家比较关注的与处方药、仿制药、生物仿制药、医疗器械相关的使用者付费法案,并对最新的收费动向进行简要分析。
1. 《处方药使用者付费法案》
Prescription Drug User Fee Act, PDUFA
最早的《处方药使用者付费法案》,即PDUFA生效于1992年,主要规定了两方面内容:一是规定FDA评审的目标完成时间或绩效目标;二是使用者付费只作为补充,而不是完全取代FDA的议会预算。
每5年,美国总统会签署并再次授权新的PDUFA。新的PDUFA内容不仅会在费率有所更改,还会加入新的规定。例如,前美国总统奥巴马于2012年7月9日签署的《食品药品监督管理安全与创新法案》(Food and Drug Administration Safety and Innovation Act, FDASIA)中,包括对PDUFA的再授权与扩展,即PDUFA V。PDUFA V延续了评审绩效目标,并添加了一些内容,例如使用现代化方法监控上市后产品的安全,扩大FDA在风险评估与减轻策略(REMS)中的作用,以及促进ECTD电子提交系统的使用。
从1992年至今,PDUFA已经更新至第六版,先行版PDUFA VI已经在2018财年(2017年10月1日-2018年9月30日)开始实施。
表2:已生效的PDUFA及对应的财年期限

表3:PDUFA V( 2017财年)VS. PDUFA VI(2018财年)
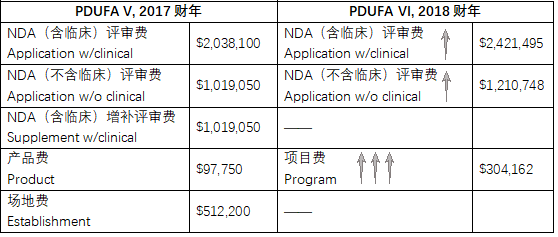
与前一版PDUFA V相比较,PDUFA VI在付费结构和费率上都有所变动:
2. 《仿制药使用者付费法案》
Generic Drug User Fee Act, GDUFA
《仿制药使用者付费法案》最早生效于2012年,与PDUFA V一样,是《食品药品监督管理安全与创新法案》(FDASIA)的一部分。





